题目内容
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
B
解析试题分析:A、因铁的金属性比铜强,形成原电池铁作负极,铁铆钉被氧化而腐蚀,正确; B、若水膜中溶解了SO2,水膜的酸性增强,则铁铆钉腐蚀的速率变大,错误;C、铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O ,正确;D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀,正确。
考点:考查金属的腐蚀与防护。

练习册系列答案
相关题目
镁―过氧化氢燃料电池具有能量高、安全方便等优点,其结构示意图如图所示。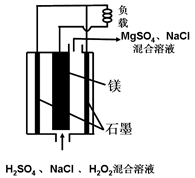
下列有关该电池的叙述中正确的是( )
| A.该电池可以在高温下正常工作 |
| B.电池工作时,正极周围溶液的PH将不断减少 |
| C.电池工作时,H+向负极移动 |
| D.该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O |
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是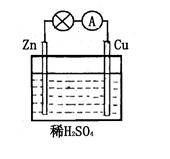
①Zn是负极
②电子由Zn经外电路流向Cu
③Zn极发生氧化反应生成Zn2+
④H+在溶液中由Cu极向Zn极迁移
| A.①②④ | B.②③④ |
| C.①②③ | D.①②③④ |
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
| A.I2发生氧化反应 | B.碘电极为该电池的正极 |
C.正极反应为:Li –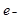 = Li+ = Li+ | D.该电池放电时化学能转化为电能 |
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
| A.保持表面干燥 | B.表面镀锌 |
| C.表面镶嵌铜块 | D.与电源负极相连 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
下列对如图所示装置实验判断的描述正确的是( )
| | a电极 | b电极 | X溶液 | 实验判断 |
| A | Cu | Zn | H2SO4 | H+向b极迁移 |
| B | Zn | Fe | H2SO4 | a、b极都放出无色气体 |
| C | Al | Mg | NaOH | a为负极,b为正极 |
| D | Cu | 石墨 | FeCl3 | a极质量减小,b极质量增加 |

2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是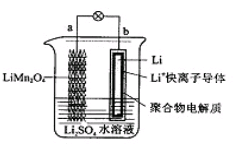
| A.a为电池的正极 |
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |