题目内容
往含0.2mol NaOH和0.1mol Ba(OH)2的混合溶液中持续稳定地通入CO2气体6.72L(标况下),则在这一过程中,溶液中离子总物质的量随通入CO2气体体积变化曲线正确的是(离子水解忽略不计)( )
A、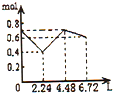 |
B、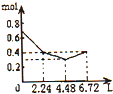 |
C、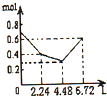 |
D、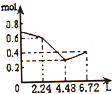 |
考点:离子方程式的有关计算
专题:图示题,计算题
分析:n(CO2)=
=0.3mol,通入含有0.2mol氢氧化钠和0.1molBa(OH)2的溶液中,发生2OH-+CO2=CO32-+H2O、OH-+CO2=HCO3-+H2O、Ba2++CO32-=BaCO3↓,以此解答该题.
| 6.72L |
| 22.4L/mol |
解答:
解:n(CO2)=
=0.3mol,
含0.2mol NaOH和0.1mol Ba(OH)2的混合溶液中,n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ba2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
,
解得x=0.1,y=0.2,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-、BaCO3+CO2+H2O=Ba2++2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大,溶液中离子为0.6mol;
所以图象C符合,
故选C.
| 6.72L |
| 22.4L/mol |
含0.2mol NaOH和0.1mol Ba(OH)2的混合溶液中,n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ba2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
|
解得x=0.1,y=0.2,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-、BaCO3+CO2+H2O=Ba2++2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大,溶液中离子为0.6mol;
所以图象C符合,
故选C.
点评:本题考查离子反应及图象,为高频考点,把握发生的离子反应及先后顺序为解答的关键,注意图象中各阶段离子的浓度变化,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、通常人们把由不到20个单糖缩合形成的糖类化合物称为低聚糖,那么低聚糖彻底水解后将得到单糖 |
| B、甲醛与尿素反应得到的脲醛树脂是一种高分子黏合剂,广泛应用于木材加工业,是居室甲醛污染的主要源头 |
| C、可以用分光光度计测定某些反应物或生成物在不同反应时刻的浓度来计算反应速率 |
| D、棉花、铜氨纤维、涤纶、油脂都是有机高分子材料 |
下列叙述与对应图式正确的是( )
A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
| |||||||||||||||||||||||||||||||||||
B、图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2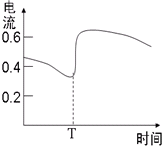 | |||||||||||||||||||||||||||||||||||
C、图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变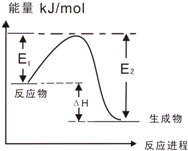 | |||||||||||||||||||||||||||||||||||
| D、表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol |
下列有关电化学原理的说法错误的是( )
| A、氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| B、电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
| C、对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 |
| D、对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 |
下列表示正确的是( )
| A、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ?mol-1 |
| C、将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
| D、在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
某元素原子的最外层有1个电子,则该元素不可能是( )
| A、IA族元素 | B、金属元素 |
| C、非金属元素 | D、惰性元素 |
下列说法中正确的是( )
| A、全部由极性键构成的分子一定是极性分子 |
| B、非极性分子中一定没有极性键 |
| C、离子化合物中一定没有共价键 |
| D、共价化合物中一定没有离子键 |
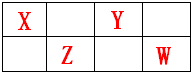 如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为1:3.下列说法正确的是( )
如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为1:3.下列说法正确的是( )A、X的最简单气态氢化物的球棍模型为: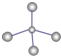 |
| B、原子半径由大到小的顺序为:W>Z>Y>X |
| C、X、Y、Z、W元素都能形成两种同素异形体 |
| D、X与Y、Z与W都能化合形成两种化合物 |