题目内容
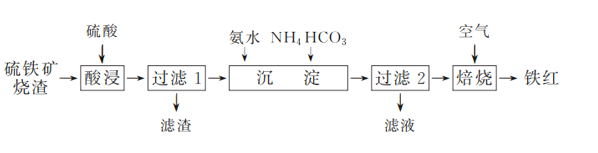
【题目】以硫酸工业的 SO2 尾气、氨水、石灰石、焦炭等为原料,可以得到有重要应用价值的 CaS、(NH4)2SO3等物质,流程如下:
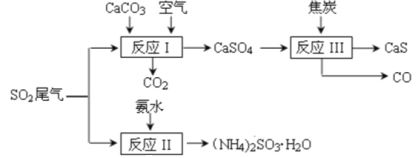
下列说法不正确的是
A. 反应Ⅰ的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2
B. 生产中反应Ⅰ中需鼓入足量的空气以保证 SO2 充分氧化生成 CaSO4;向反应Ⅱ溶液中加入适量还原性很强的物质,其目的是防止(NH4)2SO3被氧化
C. 反应Ⅲ中氧化剂与还原剂的物质的量之比为1:4
D. 将反应Ⅱ后的溶液加热到有较多固体析出,再用余热将液体蒸干,可得(NH4)2SO3H2O
【答案】D
【解析】
A. 根据流程序可知,反应Ⅰ为SO2与CaCO3、空气中的氧气反应生成硫酸钙和二氧化碳,反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2,选项A正确;
B. 生产中反应Ⅰ中需鼓入足量的空气以保证 SO2 充分氧化生成 CaSO4;SO32-具有较强还原性,容易被氧化,向反应Ⅱ溶液中加入适量还原性很强的物质,其目的是防止(NH4)2SO3被氧化,选项B正确;
C. 反应Ⅲ中发生的反应为CaSO4+4C=CaS+4CO,氧化剂CaSO4与还原剂C的物质的量之比为1:4,选项C正确;
D. 加热蒸发结晶会将液体蒸干失去结晶水,得不到(NH4)2SO3H2O,选项D不正确。
答案选D。

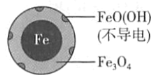
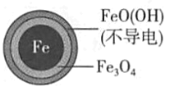
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
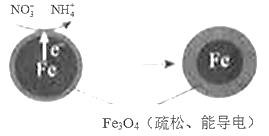
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。