题目内容
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示。
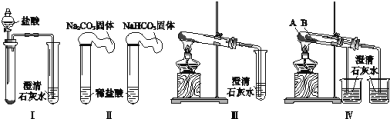
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是___(填化学式)。
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是___和___。
(3)与Ⅲ相比,IV的优点是___(填选项序号)。
a.Ⅳ比Ⅲ复杂
b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(4)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是___。
【答案】Na2CO3 2NaHCO3![]() Na2CO3+CO2↑+H2O CO2+Ca(OH)2═CaCO3↓+H2O c NaHCO3
Na2CO3+CO2↑+H2O CO2+Ca(OH)2═CaCO3↓+H2O c NaHCO3
【解析】
(1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳;
(3)根据两个实验的区别分析;
(4)根据碳酸氢钠的性质分析。
(1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多,碳酸钠中含碳量为![]() ×100%=11.3%,而碳酸氢钠中含碳量为
×100%=11.3%,而碳酸氢钠中含碳量为![]() ×100%=14.3%,所以碳酸钠放出二氧化碳量少,
×100%=14.3%,所以碳酸钠放出二氧化碳量少,
故答案为:Na2CO3;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳:2NaHCO3![]() Na2CO3+CO2↑+H2O,生产的二氧化碳通入澄清石灰水变浑浊:CO2+Ca(OH)2═CaCO3↓+H2O,
Na2CO3+CO2↑+H2O,生产的二氧化碳通入澄清石灰水变浑浊:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;
Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,
故答案选c;
(4)碳酸钠直接加热不产生气体,而碳酸氢钠不直接加热就产生气体,就更说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠,
故答案为:NaHCO3。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案