题目内容
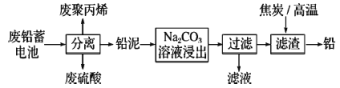
【题目】废铅蓄电池的一种回收利用工艺流程如图所示:
部分难溶电解质的性质如下表:

请回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有___(写一条)。
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥-过磷酸钙[有效成分是Ca(H2PO4)2],写出该反应的化学方程式:___。
(3)Na2CO3溶液浸出时发生的反应为CO32-(aq)十PbSO4(s)![]() PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
(4)利用铅泥中PbSO4制取PbO2的方法:PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb与KClO在强碱性条件下反应制取PbO2,写出生成PbO2的离子方程式:___。
(5)已知Pb(OH)2是既能溶于稀硝酸又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4:___。
【答案】比能量低(或笨重或废弃电池污染环境等) 2Ca5(PO4)3F+7H2SO4=7CaSO4+3Ca(H2PO4)2+2HF 1.2×105 PbCO3![]() PbO+CO2↑、2PbO+C
PbO+CO2↑、2PbO+C![]() 2Pb+CO2↑ (CH3COO)2Pb+ClO+2OH=PbO2↓+Cl+2CH3COO+H2O 取少量待测物于两支试管中,分别向两支盛有黄色沉淀的试管中加入过量KOH溶液,振荡,沉淀溶解的是PbCrO4,沉淀不溶解的是BaCrO4
2Pb+CO2↑ (CH3COO)2Pb+ClO+2OH=PbO2↓+Cl+2CH3COO+H2O 取少量待测物于两支试管中,分别向两支盛有黄色沉淀的试管中加入过量KOH溶液,振荡,沉淀溶解的是PbCrO4,沉淀不溶解的是BaCrO4
【解析】
废铅蓄电池经分离得到铅泥,加入碳酸钠溶液可生成碳酸铅,过滤后加入碳高温可生成铅;
(1)铅蓄电池较为笨重,且可引起重金属污染;
(2)结合反应原理及原子守恒写出生成过磷酸钙的化学方程式;
(3)写出反应CO32-(aq)+PbSO4(s)PbCO3(s)+SO42-(aq)的平衡常数表达式,结合Ksp(PbSO4)、Ksp(PbCO3)计算K的值;类比PbCO3和CaCO3的化学性质,写出制备Pb的化学方程式;
(4)根据题给信息推测(CH3COO)2Pb的性质,结合守恒规律写出(CH3COO)2Pb与KClO反应的离子方程式;
(5)结合两性氢氧化物的性质及表中Ksp的数值,设计合理实验方案。
废铅蓄电池经分离得到铅泥,加入碳酸钠溶液可生成碳酸铅,过滤后加入碳高温可生成铅;
(1)铅蓄电池较为笨重,且可引起重金属污染,比能量低;
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥过磷酸钙[有效成分是Ca(H2PO4)2],该反应的化学方程式为:2Ca5(PO4)3F+7H2SO4=7CaSO4+3Ca(H2PO4)2+2HF;
(3)反应CO32-(aq)+PbSO4(s)PbCO3(s)+SO42-(aq)的平衡常数K= =
= ×
×![]() =
=![]() =1.2×105,以滤渣PbCO3和焦炭为原料可制备金属铅,涉及反应为PbCO3
=1.2×105,以滤渣PbCO3和焦炭为原料可制备金属铅,涉及反应为PbCO3![]() PbO+CO2↑、2PbO+C
PbO+CO2↑、2PbO+C![]() 2Pb+CO2↑;
2Pb+CO2↑;
(4)(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,同时生成氯离子、CH3COO,反应的离子方程式为:(CH3COO)2Pb+ClO+2OH=PbO2↓+Cl+2CH3COO+H2O;
(5)Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物,则可加入过量KOH溶液鉴别,能溶解的为PbCrO4,操作方法为:取少量待测物于两支试管中,分别向两支盛有黄色沉淀的试管中加入过量KOH溶液,振荡,沉淀溶解的是PbCrO4,沉淀不溶解的是BaCrO4。

 小夫子全能检测系列答案
小夫子全能检测系列答案