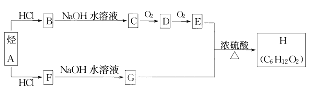
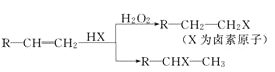
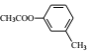
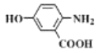
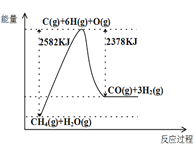
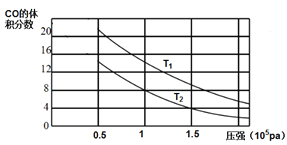
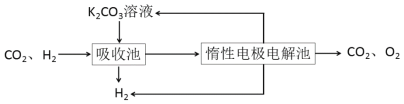
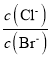题目内容
【题目】下表为长式周期表的一部分其中的编号代表对应的元素.
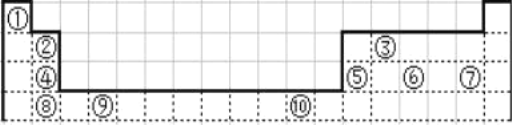
请回答下列问题:
(1)表中属于 ds 区的元素是_____(填元素符号)它的基态原子的价电子排布式为_____。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为________,其中元素③的原子的杂化类型为_____;①和⑥形成的一种常见四原子分子的化学式为______,其立体构型为_________。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为_____;该元素与元素①形成的最简单分子 X 的电子式为_____。
(4)元素⑤的电负性_____④元素的电负性(选填>、=、<下同);元素⑥的第一电离能_____原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程_____。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_____。
【答案】Cu 3d104s1 C6H6 sp2 PH3 三角锥形 3 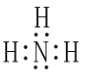 > >
> > ![]() Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
①~⑩元素分别为H、Be、C、Mg、Al、P、Cl、Ca、Ti、Cu。
(1)表中属于ds区是第IB族和IIB族元素,Cu的基态原子电子排布式为[Ar]3d104s1。
(2) 6个C原子与6个H原子形成的平面分子为苯,碳原子价层电子对数=3+0=3,H和P形成的一种常见四原子分子,先计算价层电子对数,再得立体构型。
(3)某元素原子的价电子排布式为nsnnpn+1,则n=2,该元素与元素①形成的最简单分子X为NH3。
(4)同周期,从左到右电负性逐渐增大;同周期,从左到右第一电离能具有增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
(5)元素④和⑦组成的化合物为MgCl2。
(6)上表中元素⑤的氢氧化物Al(OH)3为两性氢氧化物,Al(OH)3与NaOH溶液反应生成偏铝酸钠和水。
(1)表中属于ds区是第IB族和IIB族元素,ds区元素为Cu,它的基态原子电子排布式为[Ar]3d104s1,其价电子排布式为3d104s1;故答案为:Cu;3d104s1。
(2)表中元素①的6个原子与元素③的6个原子形成的某种平面环状分子其分子式为C6H6,碳原子价层电子对数=3+0=3,因此其碳原子的杂化类型为sp2;①和⑥形成的一种常见四原子分子的化学式为PH3,价层电子对数=![]() ,因此其立体构型为三角锥形;故答案为:C6H6;sp2;PH3;三角锥形。
,因此其立体构型为三角锥形;故答案为:C6H6;sp2;PH3;三角锥形。
(3)某元素原子的价电子排布式为nsnnpn+1,则n=2,则为N,价电子排布式为2s22p3,该元素原子的电子层上未成对电子数为3;该元素与元素①形成的最简单分子X为NH3,NH3的电子式为![]() ;故答案为:3;
;故答案为:3;![]() 。
。
(4)同周期,从左到右电负性逐渐增大,因此元素⑤的电负性>④元素的电负性;同周期,从左到右第一电离能具有增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,元素⑥的第一电离能>原子序数为 16 的元素的第一电离能;故答案为:>;>。
(5)元素④和⑦组成的化合物为MgCl2,用电子式表示元素④和⑦组成的化合物的形成过程![]() ;故答案为:
;故答案为:![]() 。
。
(6)上表中元素⑤的氢氧化物Al(OH)3为两性氢氧化物,Al(OH)3与NaOH溶液反应的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O;故答案为:Al(OH)3+NaOH=NaAlO2+2H2O。