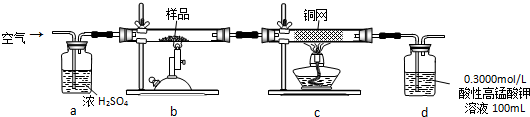
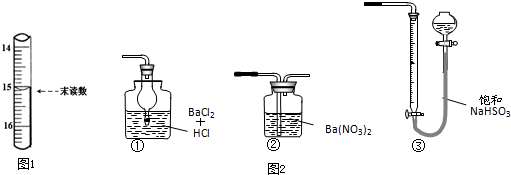
题目内容
4.最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用sp3杂化与周围氧原子成键;晶体中碳氧原子个数比为1:2;碳原子数与C-O化学键数之比为1:4.分析 根据题意知,该化合物晶体中以C-O结合为一种空间网状的无限延伸结构,所以该化合物属于原子晶体,和晶体二氧化硅的结构相似,根据原子晶体的性质分析解答.
解答 解:该化化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,所以该晶体中碳原子采用sp3杂化,晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳氧原子个数比=1:2,每个碳原子含有4个C-O共价键,所以碳原子数与C-O化学键数之比为1:4;
故答案为:sp3;1:2;1:4.
点评 本题考查晶体类型的判断及其结构的分析,该化合物和二氧化硅晶体的结构类似,根据二氧化硅的结构来分析解答即可,难度中等.

练习册系列答案
相关题目
14.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )
| A. |  称量药品 | B. |  过滤 | C. |  分离乙醇和水 | D. | 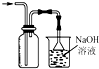 收集氯气 |
15.现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤 形,A与氢元素形成化合物AH5除了配位键外还有离子键和极性键.
(2)某同学根据上述信息,所画的C电子排布图如图违背了泡利 原理.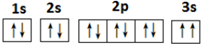
(3)DE3 中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形.检验F元素的方法是焰色反应.
(4)A2与B22+互为等电子体,B22+的电子式可表示为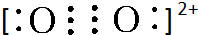 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.
(5)下列电子云图象均为成键后电子云图象,其中可表示一个E原子与一个E原子的是E,表示一个氢原子与一个E原子的是D.

| A.元素原子的核外p电子总数比s电子总数少1 |
| B.元素价电子排布式为nsnnp2n |
| C.元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| D.原子核外所有p轨道全满或半满 |
| E.元素的主族序数与周期数的差为4 |
| F.是前四周期中电负性最小的元素 |
(2)某同学根据上述信息,所画的C电子排布图如图违背了泡利 原理.

(3)DE3 中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形.检验F元素的方法是焰色反应.
(4)A2与B22+互为等电子体,B22+的电子式可表示为
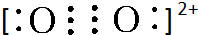 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.(5)下列电子云图象均为成键后电子云图象,其中可表示一个E原子与一个E原子的是E,表示一个氢原子与一个E原子的是D.

2.下列装置或操作能达到实验目的是( )
| A. | 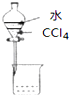 分离水和CCl4 | B. | 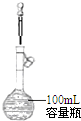 定容 | ||
| C. | 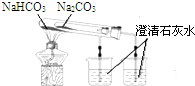 比较两种盐的热稳定性 | D. | 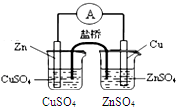 构成铜锌原电池 |
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’).