题目内容
14. 有H、O、N、Na四种元素:
有H、O、N、Na四种元素:(1)从上述四种元素中选择适当的元素,组成符合下列要求的物质,按要求填空.
①可用作清洁无污染的燃料的单质是(写化学式)H2;
②由两种元素组成的既有离子键又有非极性共价键物质的电子式是
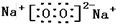 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;③常用的一种氮肥,用离子方程式解释其水溶液呈酸性的原因NH4++H2O?NH3•H2O+H+.
(2)从上术四种元素中选择三种元素,组成符合下列要求的强电解质A、B,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
①写出化学式(填其中三种):A1NaOH,A2NaNO2,B1HNO3,B2NH4NO3;
②相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为1:1;
③B1溶液中水的电离程度小于B2溶液中水的电离程度的原因是硝酸电离出的H+ 抑制了水的电离,NH4+结合水电离出的OH-,促进水的电离.
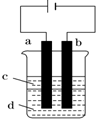
(3)由于Fe(OH)2极易被氧化,所以采用教材演示实验难使制得的白色Fe(OH)2沉淀保持较长时间观察.某化学小组设计如图所示实验装置制取纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.
①a电极材料为铁,其电极反应式为Fe-2e-=Fe2+;
②电解液d可以是上述中三种元素组成的NaOH(或NaNO3)溶液(写一种),则白色沉淀在电极(或两极之间)生成;
③液体c为苯,其作用是隔绝空气,防止Fe(OH)2被氧气氧化,在加入苯之前,对d溶液进行加热处理;
④为了在较短时间内看到白色沉淀,可以采取的措施是(写一条)适当增大电源的电压、或适当缩小两极的距离.
分析 (1)①用作清洁无污染的燃料,燃烧产物无污染;
②一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性键,不同种非金属元素之间形成极性共价键;
③硝酸铵是强酸弱碱盐,铵根离子水解使硝酸铵溶液显酸性;
(2)根据给出的元素:H、N、O、Na,其中由三种元素组成的强电解质,中学常见物质有:强碱(NaOH)、强酸(HNO3);盐:NaNO3、NaNO2、NH4NO3、NH4NO2等,A的水溶液呈碱性,B的水溶液呈酸性,a、相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,说明A1为强碱、A2为强碱弱酸盐,NaOH为强碱,NaNO2为强碱弱酸盐,所以A1为NaOH、A2为NaNO2;b.相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,说明B1是酸、B2为含有弱离子的盐,且B2溶液中只有阳离子发生水解反应,则B2为强酸弱碱盐,硝酸为强酸、硝酸铵为强酸弱碱盐,所以B1是HNO3、B2为NH4NO3;
(3)①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
②纯水导电性太差,影响物质的制备,可选择NaNO3、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀;
③苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气;
④短时间内看到白色沉淀,增大反应的速率即可.
解答 解:(1)①H、O、N、Na四种元素形成的单质氢气燃烧生成水,无污染,所以可用作清洁无污染的燃料的单质是H2,
故答案为:H2;
②过氧化钠为离子化合物,过氧化钠中钠离子和过氧根离子间存在离子键,过氧根离子中氧原子和氧原子之间存在非极性共价键,电子式为: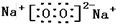 ,过氧化氢为共价化合物,分子中含有2个O-H极性键和1个O-O非极性共价键,结构式是H-O-O-H,
,过氧化氢为共价化合物,分子中含有2个O-H极性键和1个O-O非极性共价键,结构式是H-O-O-H,
故答案为: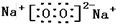 ;H-O-O-H;
;H-O-O-H;
③NH4NO3溶于水,溶液显酸性,是因为铵根离子水解使硝酸铵溶液显酸性,水解离子反应为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(2)①A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,a、相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,说明A1为强碱、A2为强碱弱酸盐,NaOH为强碱,NaNO2为强碱弱酸盐,所以A1为NaOH、A2为NaNO2;
b.相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,说明B1是酸、B2为含有弱离子的盐,且B2溶液中只有阳离子发生水解反应,则B2为强酸弱碱盐,硝酸为强酸、硝酸铵为强酸弱碱盐,所以B1是HNO3、B2为NH4NO3,
故答案为:NaOH;NaNO2;HNO3;NH4NO3;
②相同温度下,当氢氧化钠和硝酸的物质的量浓度相等时,两溶液中氢氧根离子和氢离子浓度相等,对水的电离抑制程度一样,所以水的电离程度一样的,即水电离出的氢离子的物质的量浓度之比为1:1,
故答案为:1:1;
③硝酸属于酸,对水的电离起抑制作用,硝酸铵属于盐,铵根能水解,对水的电离起到促进作用,所以硝酸溶液中水的电离程度小于硝酸铵溶液中水的电离程度,
故答案为:硝酸电离出的H+ 抑制了水的电离,NH4+结合水电离出的OH-,促进水的电离;
(3)①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
②纯水导电性太差,影响物质的制备,而NaNO3、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,则电解液b可选择NaOH(或NaNO3),白色沉淀在电极(或两极之间)生成,
故答案为:NaOH(或NaNO3);电极(或两极之间);
③苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;排尽溶液中的氧气,防止生成的氢氧化亚铁在溶液中被氧化;
④短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,
故答案为:适当增大电源的电压、或适当缩小两极的距离.
点评 本题考查无机物的推断、盐的水解、氢氧化亚铁的制备,为高频考点,侧重于弱电解质的电离平衡与影响因素等,解题的关键是理解水的电离程度变小是加入酸或者碱,因为抑制了水的电离,水的电离程度变大是加入了能水解的盐,明确电解原理及Fe为阳极是解答氢氧化亚铁的制备的关键,题目难度中等.

| A. | 水泥 | B. | 氮化硅陶瓷 | C. | 磷酸钙陶瓷 | D. | 氧化铝陶瓷 |
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA | |
| D. | 标准状况下,2.24 L已烷含有分子的数目为0.1NA |
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向Ca(ClO2)溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则溶液中一定含有SO42- | |
| B. | 氯气和二氧化硫湿润时均有漂白作用,若将二者等物质的量混合溶于水,漂白效果会增强 | |
| C. | 将稀硫酸滴到淀粉碘化钾试纸上,一段时间后变蓝,有反应4H++4I-+O2=2I2+2H2O发生 | |
| D. | 将足量的CO2逐渐通入含等物质的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物质的量与CO2的关系如图: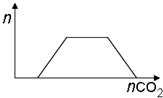 |
| A. | 用广泛pH试纸测得某溶液的pH为0 | |
| B. | 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 | |
| C. | 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
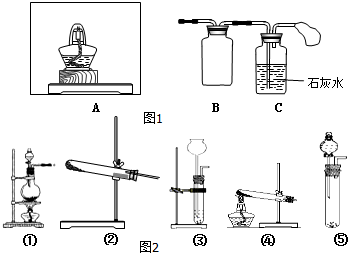 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.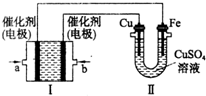 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜. 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.