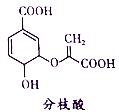
题目内容
【题目】(1)基态溴原子的价层电子轨道排布图为________。
(2)第四周期中,与溴原子未成对电子数相同的金属元素有________种。
(3)某同学画出基态碳原子的核外电子排布图为![]() ,该电子排布图违背了________。
,该电子排布图违背了________。
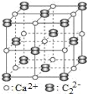
(4)CaC2 中C22-与O22+互为等电子体。
①O22+的电子式可表示为______。
②CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长。则CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示:己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度(g/cm3)为________(写出计算式即可)。
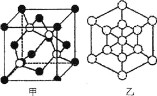
②图甲中![]() 表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用
表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用![]() 画出P原子的投影位置。__________________________
画出P原子的投影位置。__________________________

【答案】![]() 4 洪特规则
4 洪特规则 ![]() 4
4 ![]() g/cm3
g/cm3 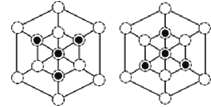
【解析】
(1)溴元素位于元素周期表第4周期第ⅦA族,最外层电子为价电子,价电子排布式为4s24p5,所以基态溴原子的价层电子轨道排布图为![]() ;
;
(2)溴原子未成对电子数为1,第四周期中,与溴原子未成对电子数相同的金属元素有K(4s1)、Sc(3d14s2)、Cu(3d104s1)、Ga(4s24p1),共4种;
(3)洪特规则规定:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。基态碳原子的核外电子排布图应为![]() ,该同学画出的基态碳原子的核外电子排布图
,该同学画出的基态碳原子的核外电子排布图![]() ,违背了洪特规则;
,违背了洪特规则;
(4)①C22-与O22+互为等电子体,等电子体结构相似,C22-中两个碳原子共用三对电子,所以O22+中的两个氧原子间也应该共用三对电子,电子式可表示为![]() ;
;
②CaC2晶体的晶胞结构与 NaCl 晶体的相似,所以每个Ca2+周围有6个C22-,分布在以此Ca2+为中心的正方形的四个顶点和上下底面的面心,但CaC2晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。所以上下两个底面的C22-与Ca2+的距离大于同一层上的4个C22-与Ca2+的距离,所以CaC2晶体中与1个Ca2+周围距离最近的C22-数目为4;
(5)①根据磷化硼晶体晶胞可知,在一个晶胞中有4个磷原子和4个硼原子,则一个晶胞的质量为![]() g。晶胞边长apm,即aⅹ10-10cm,所以一个晶胞的体积为(aⅹ10-10)3cm3,所以磷化硼晶体的密度为
g。晶胞边长apm,即aⅹ10-10cm,所以一个晶胞的体积为(aⅹ10-10)3cm3,所以磷化硼晶体的密度为![]() g/cm3;
g/cm3;
②根据晶胞结构,沿着对角线方向投影,可以观察到六边形,中心P与B重合,六边形中形成两个倒立关系的正三角形,分别由3个B或3个P构成,所以画图为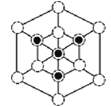 或
或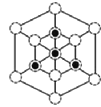 。
。