题目内容
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
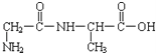
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
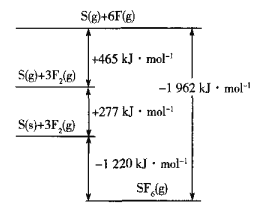
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
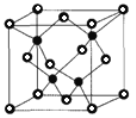
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
【答案】X-射线衍射 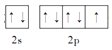 V形 H2O、NH2- sp3 AB 155 327 CuCl为分子晶体,CuF为离子晶体
V形 H2O、NH2- sp3 AB 155 327 CuCl为分子晶体,CuF为离子晶体 ![]() ×107
×107
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)F的原子序数为9,价电子排布式为2s22p5;
(3)根据等电子体原理分析解答;
(4)NH4+的N原子形成4个σ键,没有孤电子对;氟化铵为离子化合物,含有离子键和共价键;
(5)由图象可知,断裂3molF-F键,吸收465kJ能量,形成6molS-F键,放出1962kJ能量,据此计算;
(6)①CuCl熔化时几乎不导电,应为分子晶体,而CuF为离子晶体;②根据均摊法计算晶胞中含有的Cu、F的数目,再结合晶体的密度列式计算。
(1)从外观无法区分晶体、准晶体和非晶体,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过X-射线衍射实验可区分晶体、准晶体和非晶体,故答案为:X-射线衍射;
(2)F的原子序数为9,价电子排布式为2s22p5,因此基态F原子的价电子排布图为 ,故答案为
,故答案为 ;
;
(3)[H2F]+与H2O、NH2-等互为等电子体,结构相似,为V形,故答案为:V形;H2O、NH2-;
(4)NH4+的N原子形成4个σ键,没有孤电子对,采用sp3杂化,氟化铵为离子化合物,含有离子键和共价键,即σ键,故选AB,故答案为:sp3;AB;
(5)由图象可知,断裂3molF-F键,吸收465kJ能量,则F-F键的键能为155kJmol-1,形成6molS-F键,放出1962kJ能量,则S-F的键能为![]() kJmol-1=327kJmol-1,故答案为:155;327;
kJmol-1=327kJmol-1,故答案为:155;327;
(6)①CuCl的熔点为426℃,熔化时几乎不导电,应为分子晶体,而CuF为离子晶体,一般,离子晶体的熔沸点比分子晶体高,则CuF比CuCl熔点高,故答案为:CuCl为分子晶体,CuF为离子晶体;
②CuF的密度为7.1gcm-3,晶胞中Cu、F的个数分别为4,(其中○为8×![]() +6×
+6×![]() =4),则晶胞的密度=
=4),则晶胞的密度= gcm-3=7.1gcm-3,a=
gcm-3=7.1gcm-3,a=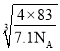 ×107nm,故答案为:
×107nm,故答案为: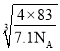 ×107。
×107。