题目内容
【题目】三位化学家因研究锂电池做出开创性贡献而获得2019年诺贝尔化学奖。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点;成为目前广泛使用的锂电池。
(1)铁元素在元素周期表中的位置__;LiFePO4中Fe2+基态电子排布式是__。
(2)P的电负性___O的电负性(填写“大于”“小于”或“等于”);PO43-的空间构型是__,中心原子的杂化方式是___。
(3)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是__。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为__,其中Fe的配位数为__。
(5)有一种蓝色晶体[可表示为:KFex(CN)6,相对分子质量为Mr],经研究发现,其晶胞的![]() 如图所示(K+未画出)。
如图所示(K+未画出)。
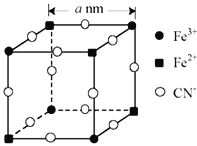
①晶体中与每个Fe3+距离最近且等距离的CN-有__个。
②该晶体的化学式为__。
③若晶胞中每个Fe3+和Fe2+距离用anm表示,则晶体的密度表达式是__g/cm3。
【答案】第四周期Ⅷ族 [Ar]3d6 小于 正四面体 sp3 Li+核电荷数较大 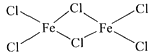 4 6 KFe2(CN)6
4 6 KFe2(CN)6 ![]()
【解析】
(1)铁元素为26号元素,根据铁原子的核外电子排布式书写Fe2+基态电子排布式;
(2)非金属性越强则电负性越强;根据磷原子价层电子对互斥理论确定其空间构型及磷原子的杂化方式;
(3)电子层结构相同的离子,离子核电荷数越大,其吸引电子能力越大;
(4)在氯化铁双聚分子中,铁原子除了与3个氯原子形成共价键外,还能接受另一个氯原子提供的孤电子对而形成配位键;
(5)①根据晶胞图示分析判断;
②由图可推出晶体中阴离子的最小结构单元中含Fe2+、Fe3+、CN-的个数,结合化合物化合价为0分析解答;
③结合最小结构单元晶胞图示,根据密度公式解答。
(1)铁元素为26号元素,位于周期表中第四周期Ⅷ族,铁原子的核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,则Fe2+基态电子排布式:1s22s22p63s23p63d6或[Ar]3d6;
(2)非金属性越强其电负性越强,非金属性P<O,则电负性P小于O;PO43-中P原子的价层电子对数=4+![]() ×(5+34×2)=4,所以P原子按sp3方式杂化,P原子周围不含孤电子对,所以其空间构型正四面体;
×(5+34×2)=4,所以P原子按sp3方式杂化,P原子周围不含孤电子对,所以其空间构型正四面体;
(3)Li+与H-具有相同的电子构型,Li+核电荷数为3,H-核电荷数为1,电子结构相同时,Li+核电荷数越大,原子核对核外电子的吸引能力越大,离子半径就越小,则r(Li+)小于r(H-);
(4)氯化铁的双聚体,就是两个氯化铁相连接在一起,已知氯化铁的化学键有明显的共价性所以仿照共价键的形式将两个氯化铁连接在一起,即结构式为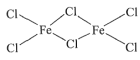 ,因此Fe的配位数为4;
,因此Fe的配位数为4;
(5)①由图可看出与每个Fe3+上下、左右、前后各一个CN,故距离最近且等距离的CN为6个;
②由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×![]() =
=![]() ,同样可推出含Fe3+个数也为
,同样可推出含Fe3+个数也为![]() ,CN为12×
,CN为12×![]() =3,因此阴离子为[Fe2(CN)6],则该晶体的化学式只能为KFe2(CN)6;
=3,因此阴离子为[Fe2(CN)6],则该晶体的化学式只能为KFe2(CN)6;
③由②分析,结合最小结构单元晶胞图示,晶胞边长为2anm,则整个晶胞的体积V=(2anm)3=8a3×10-21 cm3,整个晶胞中Fe2+个数为:8×![]() =4,Fe3+个数也为4,CN个数为3×8=24,即整个晶胞的摩尔质量为4
=4,Fe3+个数也为4,CN个数为3×8=24,即整个晶胞的摩尔质量为4![]() ,根据密度公式
,根据密度公式![]() 。
。

 金钥匙试卷系列答案
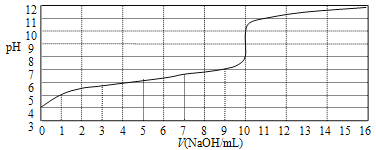
金钥匙试卷系列答案【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
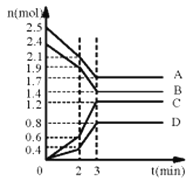
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。
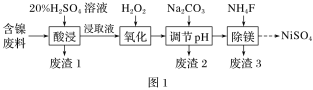
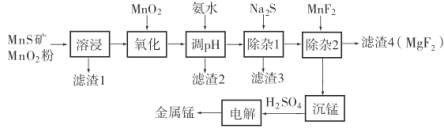
【题目】锰不仅在工业上用途广泛,还是人体内必需的微量元素,对人体健康起着重要的作用。一种以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备金属锰的流程如图所示。请回答下列问题:
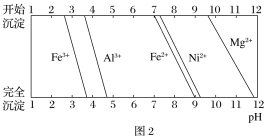
相关金属离子![]() 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
|
|
|
开始沉淀pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中需加入的试剂是________(填化学式)。
(2)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(3)“滤渣2”的主要成分是________________________________(填化学式)。
(4)![]() 可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
可做“沉锰”试剂,该物质的水溶液呈碱性,其溶液中离子浓度由大到小的顺序为________________________________。
(5)“沉锰”得到![]() 沉淀,写出该反应的离子方程式________________。
沉淀,写出该反应的离子方程式________________。
(6)电解硫酸锰溶液制备单质锰时,阴极的电极反应为________;电解后的电解质溶液可返回________工序继续使用。
【题目】重铬酸钾(K2Cr2O7)为用途极广的含铬化合物,可用于制备铬矾、火柴、铬颜料,并用于鞣革、电镀、有机合成等。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O2晶体的过程如图所示
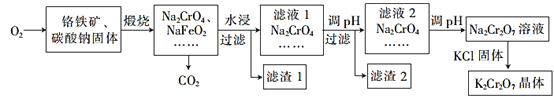
根据题意回答下列问题:
(1)煅烧时,铬铁矿发生复杂反应生成Na2CrO4和 NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式为___。
(2) NaFeO2遇水强烈水解生成滤渣1,反应的离子方程式为______。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7~8的目的为_____;滤液2调节pH约为5的目的是_____。
物质 | 溶解度(g/100g) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。分析此法能够制得K2Cr2O7晶体的原因:____;为了从溶液中得到较多K2Cr2O7晶体的操作过程是____、____、过滤、洗涤、干燥。
(5)KCr2O7产品含量测定:准确称取试样2.5g,配成250ml溶液,用移液管吸取25.00mL溶液于碘量瓶中,加入10mL2mol·L-1硫酸、2gKI,放于暗处5min,另加l00m水,用0.2000mol·L-1Na2S2O3标准液滴定至溶液呈黄绿色,再加人3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。进行平行实验三次,平均消耗NaS2O3标准液的体积为25.00mL.K2Cr2O7产品的纯度为______。已知有关反应如下:![]() ;
;![]()