��Ŀ����
����Ŀ����Ϣɸѡ��
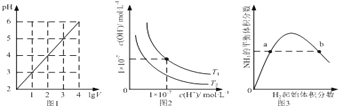
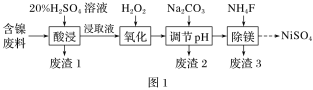
��.ij����(NiO)��������FeO��Al2O3��MgO��SiO2�����ʣ��ô˷�����ȡNiSO4�Ĺ���������ͼ1��ʾ��
��֪����SiO2������ϡ���ᡣ
��Ksp(MgF2)��7.4��10��11��
���йؽ���������������������������pH��ͼ2��ʾ��
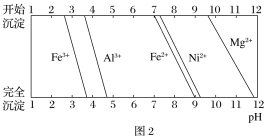
(1)��Na2CO3������Һ��pH��5���õ�����2����Ҫ�ɷ���_______________(�ѧʽ)��
(2)Mg���뱥��NH4Cl��Һ��Ӧ����NH3�����û�ѧƽ���ƶ�ԭ�����Խ��ͣ�___(�ñ�Ҫ�����ֺ����ӷ���ʽ�ش�)��
(3)��֪����ǰ��Һ��c(Mg2��)��1.85��10��3 mol��L��1������þ�ʴﵽ99%ʱ����Һ��c(F��)��_________mol��L��1��
(4)��NaOH��Һ����NaClO��NiSO4��Ӧ���Ƶ�NiO(OH)����ѧ����ʽΪ______��
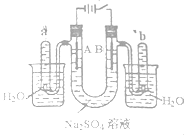
�ζ�����һ����Ҫ�Ķ�������������Ӧ�÷�Χ�ܹ㡣ʵ���ҿ�ͨ���ζ��ķ����ⶨ������������Ʒ�Ĵ���(���ʲ����뷴Ӧ)���ⶨ�������£���֪��Ag����SCN��=AgSCN��(��ɫ)��
(1)��ȡ2.000g�Ʊ�����������Ʒ����ˮ�ܽ⣬���ݵ�100mL����Һ���ƹ��� �����õIJ����������ձ������������_____________________________��
(2)ȷ��ȡ25.00mL��Һ���ữ����뼸����立�[NH4Fe(SO4)2]��Һ��ָʾ��������0.100mol��L��1NH4SCN����Һ�ζ����ζ��յ��ʵ������Ϊ__________��
(3)���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ������и�������ʧ������������������������________(����ƫ������ƫ��������������)��
���𰸡�Fe(OH)3��Al(OH)3 NH4Clˮ�����H����NH4+��H2O![]() NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2�� 2.0��10��4 2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O 100mL����ƿ����ͷ�ι� ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ ƫ��
NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2�� 2.0��10��4 2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O 100mL����ƿ����ͷ�ι� ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ ƫ��
��������
����(NiO)��������FeO��Al2O3��MgO��SiO2�����ʣ����������SiO2����ӦΪ����1������ɷ�ת��ΪFe2+��Al3+��Mg2+��ȡ���Һ������H2O2��Fe2+������ΪFe3+������̼���Ƶ�����Һ���ȣ����ݳ���ͼ���֪������2Ϊ��������������������
(1)���ݳ���ͼ���֪����Na2CO3������Һ��pH��5ʱ��Fe3+��Al3+����ȫ�������õ�����2����Ҫ�ɷ���Fe(OH)3��Al(OH)3��
(2)Mg���뱥��NH4Cl��Һ��Ӧ����NH3��NH4Clˮ�����H����NH4+��H2O![]() NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2����
NH3��H2O��H����Mg��H����Ӧ����H2��ʹc(H��)��С���ٽ�����ƽ�������ƶ������ɵ�NH3��H2O���ַֽ����NH3���ܷ�Ӧ�����ӷ���ʽΪMg��2NH4+=Mg2����2NH3����H2����
(3)��֪![]() ������þ�ʴﵽ99%ʱ��������Ϊ��ȫ����ʱ����Һ��c(F��)��
������þ�ʴﵽ99%ʱ��������Ϊ��ȫ����ʱ����Һ��c(F��)��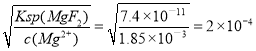 mol��L��1��
mol��L��1��
(4)��������ԭ��Ӧԭ����֪��2NiSO4��NaClO��4NaOH=2Na2SO4��NaCl��2NiO(OH)��H2O��
�� (1)������Һʱ������Ҫ�IJ�����������Ͳ��100mL����ƿ����ͷ�ιܡ�
(2) ��֪��ӦΪAg����SCN��=AgSCN��(��ɫ)����ζ����յ�ʱ����Һ�е�SCN����ʣ�࣬����立�[NH4Fe(SO4)2]��Һ�е�Fe3+��Ӧ��Һ��Ϊ��ɫ������Ϊ����һ�α���Һ����Һ��Ϊ��ɫ����30���ڲ���ɫ��
(3)���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ������и�������ʧ����ζ������еı�Һʵ������ƫ����������������������ƫ�ߡ�

 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
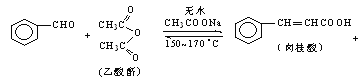
��ʱ�ƿ�������ϰϵ�д�����Ŀ������������ϡ���ױƷ��ҽҩ�����Ϻй���֬�ȵ���Ҫԭ�ϣ�ʵ���������з�Ӧ��ȡ����ᣮ
 CH3COOH
CH3COOH
ҩƷ��������
����ȩ | ������ | ����� | ���� | |
�ܽ�ȣ�25�棬g/100gˮ�� | 0.3 | ����ˮˮ�� | 0.04 | ���� |
�е㣨�棩 | 179.6 | 138.6 | 300 | 118 |
��գ�
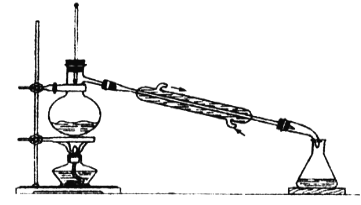
�ϳɣ���Ӧװ����ͼ��ʾ����������ƿ���Ⱥ������ϸ����ˮ�����ơ�����ȩ������������ʹ֮��Ͼ��ȣ� ��150��170�����1Сʱ��������״̬��
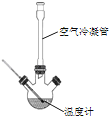
��1�����������ܵ�������__��
��2����װ�õļ��ȷ�����__�����Ȼ���Ҫ���Ʒ�Ӧ����״̬��������ҷ��ڣ��ᵼ���������ʽ��ͣ����ܵ�ԭ����______��
��3�������ô����ƾ��壨CH3COONa3H2O����ԭ����______��
��Ʒ���ƣ���������Ӧ��õ��Ļ������ȵ���Բ����ƿ�У��������в�����
��Ӧ�����![]()
![]()
![]()
![]()
![]() ����ᾧ��
����ᾧ��
��4���ӱ���Na2CO3��Һ����ת�����ᣬ��ҪĿ����_______��
��5������I��__������������ᾧ������Ȼ�����ʣ�����ߴ��ȿ��Խ��еIJ�����__������������ƣ���
��6�����ʵ�鷽�������Ʒ���Ƿ��б���ȩ_______��