题目内容
【题目】(1)若电解饱和食盐水时消耗117gNaCl,则理论上最多可得到___L(标准状况)氯气。
(2)为测定K2SO4溶液的浓度,取25.00mL待测液,向其中加入过量BaCl2溶液,充分反应后过滤并干燥,得到白色沉淀的质量是1.165g。该K2SO4溶液的物质的量浓度是多少?___(写出具体的计算过程)
【答案】22.4 解:设硫酸钾的物质的量为x
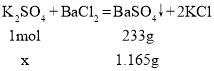
x=0.005mol
c(K2SO4)= =0.2mol/L
=0.2mol/L
答:该硫酸钾溶液的物质的量浓度是0.2mol/L。
【解析】
(1)解:若电解饱和食盐水时消耗NaCl 117g,反应的n(NaCl)=  =2mol:
=2mol: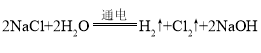
依据化学方程式得到:n(Cl2)=n(NaCl)×![]() =1mol,标准状况下1mol Cl2的体积:V(Cl2)= 22.4L;
=1mol,标准状况下1mol Cl2的体积:V(Cl2)= 22.4L;
(2)此题已知产物硫酸钡的质量,求硫酸钾的物质的量,就能解出硫酸钾的浓度,可以用相当关系解题。
解:设硫酸钾的物质的量为x
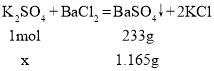
x=0.005mol
c(K2SO4)= =0.2mol/L
=0.2mol/L
答:该硫酸钾溶液的物质的量浓度是0.2mol/L。

练习册系列答案
相关题目