题目内容
【题目】常温下,已知醋酸的电离常数为1.75×10-5,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法正确的是(已知![]() =4.2)
=4.2)
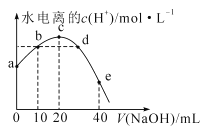
A.b、d两点溶液的pH相同
B.b点溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.e点所示溶液中,c(Na+)=2[c(CH3COO-)+c(CH3COOH)]=0.005mol/L
D.a点坐标为(0,2.4×10-11)
【答案】D
【解析】
CH3COOH溶液中加入NaOH发生CH3COOH+NaOH=CH3COONa+H2O,酸、碱抑制水的电离,CH3COONa为强碱弱酸盐,促进水的电离,向醋酸溶液中加入NaOH溶液,水的电离程度先增大后减小,据此分析;
A. CH3COOH溶液中加入NaOH发生CH3COOH+NaOH=CH3COONa+H2O,b点消耗NaOH的体积为10mL,NaOH和CH3COOH的物质的量浓度相等,则此时溶液中溶质为CH3COOH和CH3COONa,且两者物质的量相等,CH3COO-的水解常数为![]() <1.75×10-5,CH3COOH的电离大于CH3COO-水解,即b点溶液显酸性,d点溶质为CH3COONa和NaOH,溶液显碱性,b、d两点pH不相同,故A错误;
<1.75×10-5,CH3COOH的电离大于CH3COO-水解,即b点溶液显酸性,d点溶质为CH3COONa和NaOH,溶液显碱性,b、d两点pH不相同,故A错误;
B. 根据A选项分析,b点溶液中溶质为CH3COOH和CH3COONa,且两者物质的量相等,CH3COOH的电离大于CH3COO-的水解,因此离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C. e点溶质为CH3COONa和NaOH,且两者物质的量相等,根据物料守恒,因此有c(Na+)=2[c(CH3COOH)+c(CH3COO-)]=![]() ,故C错误;
,故C错误;
D. CH3COO发生电离:CH3COOH ![]() CH3COO-+H+,电离平衡常数Ka=
CH3COO-+H+,电离平衡常数Ka=![]() =1.75×10-5,因此有c2(H+)=1.75×10-7,即c(H+)=4.2×10-4mol·L-1,根据水的离子积,则溶液中c(OH-)=
=1.75×10-5,因此有c2(H+)=1.75×10-7,即c(H+)=4.2×10-4mol·L-1,根据水的离子积,则溶液中c(OH-)=![]() ≈2.4×10-11 ,即水电离出的c(H+)=2.4×10-11mol·L-1,故D正确;
≈2.4×10-11 ,即水电离出的c(H+)=2.4×10-11mol·L-1,故D正确;
答案:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案