题目内容
12.下列说法中,正确的是( )| A. | 乙烯的摩尔质量为28 | |
| B. | 标准状况下,11.2 L四氯化碳所含分子数为0.5 NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 16g CH4所含电子数目为10NA |
分析 A、摩尔质量的单位为g/mol;
B、标况下,四氯化碳为液体;
C、CO32-为弱酸根,在溶液中会水解;
D、求出甲烷的物质的量,然后根据甲烷为10电子微粒来分析.
解答 解:A、摩尔质量的单位为g/mol,故乙烯的摩尔质量为28g/mol,故A错误;
B、标况下,四氯化碳为液体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、CO32-为弱酸根,在溶液中会水解,故在溶液中其个数小于0.1NA个,故C错误;
D、16g甲烷的物质的量为1mol,而甲烷为10电子微粒,故1mol甲烷中含10mol电子即10NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
5.下列元素的原子在形成不同物质时,既能形成离子键又能形成极性键和非极性键的是( )
| A. | Na | B. | Mg | C. | Cl | D. | Ne |
3.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 工业上利用电解YCl3来获得金属单质Y | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 可以利用电解法获得金属单质X |
20.将物质的量相同的NH3•H2O和NH4Cl混合配成溶液,则下列关系错误的是( )
| A. | c(OH-)>c(H+) | B. | c(NH4+)>c(NH3•H2O) | ||
| C. | c(NH4+)>c(H+)=c(OH-)>c(Cl-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
17.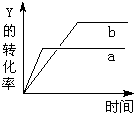 反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
 反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )
反应 X(气)+Y(气)?2Z(气)△H<0,在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是( )| A. | 加入催化剂 | B. | 增大压强 | C. | 降低温度 | D. | 增大Y的浓度 |