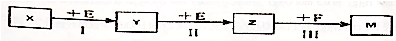题目内容
9. 反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )| A. | > | B. | = | ||
| C. | < | D. | 条件不足,无法判断 |
分析 此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变,由此分析解答.
解答 解:第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,故选:A.
点评 本题考查化学反应速率与化学平衡图象、化学平衡影响因素等,难度中等,学生应注意化学平衡移动原理的应用.

练习册系列答案
相关题目
17.下列各项中表达正确的是( )
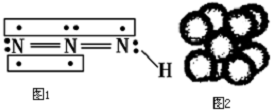
| A. | F-的结构示意图: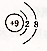 | B. | CH4分子的比例模型: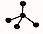 | ||
| C. | CCl4的电子式: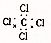 | D. | 甲烷的结构简式: |
14.关于如图所示装置的说法正确的是( )
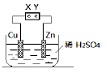

| A. | 直接连接X、Y,则该装置可将电能转变为化学能 | |
| B. | 直接连接X、Y,生成2.24LH2时一定转移0.2mole- | |
| C. | 将X、Y与直流电源相连,一段时间后,Zn片质量一定减少 | |
| D. | 将X、Y与直流电源相连,则该装置可能发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ |
1.4g NaOH溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液物质的量浓度是( )
| A. | 1mol/L | B. | 10mol/L | C. | 0.01mol/L | D. | 0.1mol/L |
18.W,X,Y,Z是短周期元素,其部分性质如表,下列说法正确的是( )
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | X在自然界中以游离态和化合态形式存在 |
19.下列关于乙烯和苯的性质的叙述中,错误的是( )
| A. | 乙烯能使溴水褪色 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 将苯加入溴水中,因苯能与溴水发生加成反应而使溴水褪色 | |
| D. | 50~60℃时,在浓硫酸存在下,苯能与浓硝酸反应生成硝基苯 |
 .
.
 (1)已知:
(1)已知: