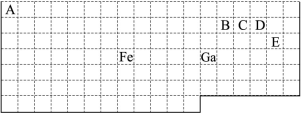
题目内容
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X是元素周期表中原子半径最小的元素,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。 请回答下列问题:
(1)Y在元素周期表中的位置为 ,ZX的电子式为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作消毒剂的有 、 (写出其中两种物质的化学式)。
(4)X2M的标准燃烧热ΔH=-a kJ·mol-1,写出表示X2M标准燃烧热的热化学方程式: 。
(1)第二周期ⅥA族,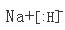
(2) HClO4,H2S
(3)O3、Cl2、ClO2(写出2种即可)
解析试题分析:X是元素周期表中原子半径最小的元素,X是H元素;X、Z同主族,可形成离子化合物ZX,Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子。则Y、M是O、S元素;G只能是Cl元素。
(1)O在元素周期表中的位置为第二周期ⅥA族,NaH是离子化合物,所以电子式为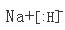
(2)上述元素的最高价氧化物对应的水化物酸性最强的也是非金属性最强的,是氯元素对应的高氯酸分子式为HClO4,非金属气态氢化物还原性最强的也是非金属性最弱的,是S对应的硫化氢,化学式为H2S;
(3)O、Cl的单质或两元素之间形成的化合物可作消毒剂的有O3、Cl2、ClO2
(4)H2S对应的稳定氧化物是液态水和气态二氧化硫,所以X2M标准燃烧热的热化学方程式为:
H2S(g)+3/2O2(g)= H2O(l)+SO2(g) ΔH=-a kJ·mol-1
考点:考查元素推断,电子式、化学式、热化学方程式的书写,化学与生活的联系

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
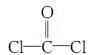 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是 ;
(2)C和H的气态氢化物的稳定性强弱关系为 (用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3=2 +CO2
横线上某盐的化学式应为 。
(5)在一密闭容器中发生反应2AD2+D2
 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。绘出该实验方案装置图。