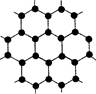
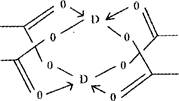
题目内容
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(1)镁;(2)Mn;(3)E;(4)N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol;
(5)乙醇分子间能形成氢键,而二甲醚不能。(6)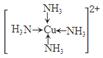
解析试题分析:(1)钠、镁、铝是同一周期的元素,随着原子序数的增大,原子半径逐渐减小,元素失去电子逐渐减弱,乙醇元素的第一电离能逐渐增大,但是Mg原子的2s轨道上的电子处于全充满的稳定状态,失去电子比后面相邻的Al还难。故这三种元素中第一电离能最大的是Mg;(2)失去2个电子后的某正二价阳离子核外电子排布式为[Ar]3d54s0,有23个电子,则原子有25个电子,所以是25号元素Mn。(3)A. NH4Cl晶体是离子晶体,含有离子键、极性共价键、配位键。错误。B. Na3AlF6晶体是离子晶体,含有离子键、共价键配位键。错误。C. Na2CO3?10H2O晶体是离子晶体,含有离子键、极性共价键、配位键。错误。D. CuSO4溶液中含有离子键、共价键、配位键。错误。E. CH3COOH溶液中含有CH3COOH分子内的极性共价键、非极性性共价键;分子之间的范德华力、氢键、H+与H2O之间的配位键。正确。(4)反应热就是断裂化学键吸收的能量与形成化学键释放的能量的差值。根据各种物质的键能可计算出氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol;(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能。(6)Cu被H2O2氧化为Cu2+,在浓氨水中形成[Cu(NH3)4] 2+而使溶液深蓝色,呈深蓝色的离子的结构简式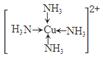 。
。
考点:考查元素的电离能、元素的推断、物质微粒的作用力、热化学方程式的书写及铜氨络离子的结构。

 阅读快车系列答案
阅读快车系列答案(15分)X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
(2)Y的电负性比Z 的 (填“大“或”小”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为 。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式: 。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式: 。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
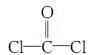 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。