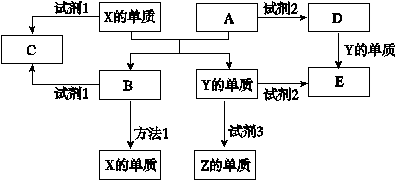
题目内容
物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题: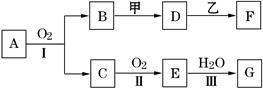
请回答些列问题:
(1)写出甲的电子式是 .
(2)写出反应Ⅰ的化学方程式 .
(3)A溶于水得到得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为 用含a和b的代数式表示出该混合溶液中X的电离平衡常数 .
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图装置处理污水.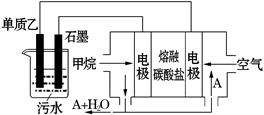
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ. ;Ⅱ. .
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .
(每空2分,共14分)
(1)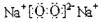 (2分) (2)4NH3+5O2
(2分) (2)4NH3+5O2 4NO+6H2O (2分)
4NO+6H2O (2分)
(3)c(NO3—)=c(NH4+)>c(OH—)= c(H+) ; 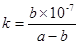 (各2分,共4分)
(各2分,共4分)
(4)①Al-3e— = Al3— ; 4OH- - 4e-= 2H2O + O2↑ ②CO2(各2分,共6分)
解析试题分析:
(1)由题干信息可知甲为过氧化钠;
(2)反应Ⅰ涉及氨的催化氧化;
(3)溶液X为氨水。如果溶液呈中性,则氨水过量,混合后的溶质为NH4NO3和NH3·H2O,根据溶液中电荷守恒,可得:c(NO3—)=c(NH4+)>c(OH—)= c(H+)
NH3·H2O  NH4+ + OH—
NH4+ + OH—
K = 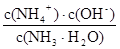
c(NH4+)= c(NO3—)=b mol·L-1; c(OH—)=10-7 mol·L-1 ; c(NH3·H2O)=(a – b) mol·L-1
代入计算可得答案。
(4)单质乙为Al,非惰性电极做阳极,优先放电,同时OH—在阳极也会放电。
熔融的碳酸盐为电解质,则正极反应为:2O2 + 8 e- + 4CO2 = 4CO32-
负极反应为:CH4 – 8 e- +4CO32- = 5CO2 + 2H2O
所以必须有CO2参与循环反应。
考点:本题考查了溶液中三个守恒关系式,化学平衡常数的计算,电极反应方程式的书写等,综合性比较强,要求学生分析问题,提取题干信息的能力。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案根据下列各反应现象所归纳的元素性质不正确的是
| A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出。不能说明钠的金属性比铜弱 |
| B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝。说明氯元素的非金属性比碘元素强 |
| C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出。说明Cl的非金属性比S强 |
| D.将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol。说明这三种金属的活泼性为:Al>Mg>Na |
下述实验设计能够达到目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 证明Ksp(AgCl)﹥Ksp(AgI) | 往AgCl悬浊液中滴入KI浓溶液 |
| B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
从下列事实所得出的相应结论正确的是( )
| | 实验事实 | 结论 |
| ① | 在相同温度下,向1 mL 0.2 mol·L-1 NaOH溶 液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生 白色沉淀后,再滴加2滴0.1 mol·L-1 FeCl3 溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 已知反应5Cl2+I2+6H2O=2HIO3+ 10HCl,2BrO+Cl2=2ClO+Br2 | 氧化性强弱顺序:BrO>Cl2>ClO>IO |
| ④ | 测定等物质的量浓度的Na2SO4与Na2CO3溶 液的pH,后者较大 | 非金属性:S>C |
A.③④ B.②④ C.①②③ D.全部
 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。