题目内容
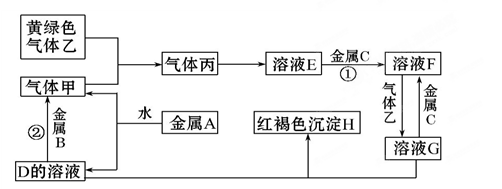
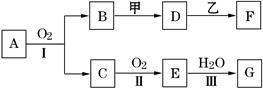
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系:
(1)推断化学式:X ;A ;B ;D 。
(2)写出C→E反应的化学方程式 。
(3)写出X→A反应的离子方程式(OH-足量) 。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式: 。
(1)NH4HCO3(1分);NH3(1分);H2O(1分);NO(1分)
(2)2Na2O2+2CO2=2Na2CO3+O2(2分)
(3) NH4++HCO3-+2OH-=CO32-+2H2O+NH3↑(2分)
(4) 4C3H5N3O9+5O2→12NO+12CO2+10H2O(2分)
解析试题分析:根据转化图可知,A既能与酸反应,也能和碱反应且均生成气体,因此A是弱酸的铵盐,则A是氨气。C能和过氧化钠反应生成E,则E应该是氧气,C是CO2。氨气和氧气发生催化氧化生成NO和水,即D是NO。B是液态,则B应该是水。又因为X受热分解生成A、B、C的物质的量相等,所以X是碳酸氢铵。
(1)根据以上分析可知,X、A、B、D的化学式分别是NH4HCO3、NH3、H2O、NO。
(2)过氧化钠和CO2反应生成碳酸钠和氧气,则C→E反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(3)碳酸氢铵与足量强碱反应的离子方程式为NH4++HCO3-+2OH-=CO32-+2H2O+NH3↑。
(4)三硝酸甘油酯在催化剂的作用下被氧化生成NO、CO2和水,反应的化学方程式为4C3H5N3O9+5O2→12NO+12CO2+10H2O。
考点:考查无机框图题的有关判断

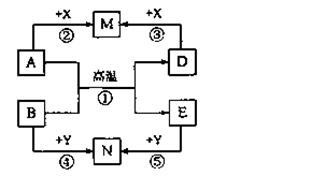
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):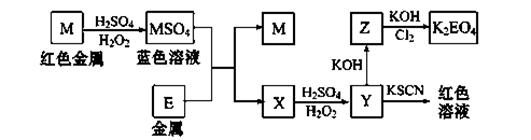
(1)写出M溶于稀硫酸和H2O2混合液的化学方程式: 。
(2)写出X→Y的离子方程式: 。
(3)写出Cl2将Z氧化为K2EO4的化学方程式: 。
②K2EO4是一种新型的自来水处理剂,它的性质和作用是 。
| A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
下列反应中,反应后固体物质增重的是
| A.乙醇蒸气通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与V2O5发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是( )
| A.将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体 |
| B.用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中含Na+ |
| C.在AgNO3的溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强 |
| D.浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有吸水性 |