��Ŀ����
����Ŀ��������ѧԭ����������и���
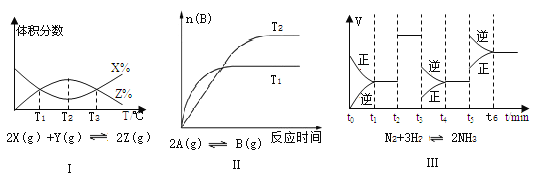
(1)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��Ӧ��N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
��ѧ�� | H��H | N��H | N��N |
����/(kJ/mol) | 436 | a | 945 |
(2)25 ��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________(��ᡱ������С�)�ԡ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
(3)����BaSO4�ı�����Һ��
������Na2SO4��Һ,��c(Ba2+)__________(���������������С����������������ͬ)��
�����ļӸ���Ĺ���BaSO4����c(Ba2+)��__________��
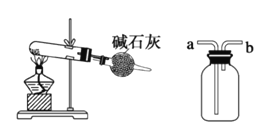
(4)Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________��
�����һ��ʱ�䣬�������������������Ϊ112 mL (��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��
���𰸡�391 �� ![]() ��С ���� Cl--5e-+2H2O=ClO2����4H+ 0.01
��С ���� Cl--5e-+2H2O=ClO2����4H+ 0.01
��������
(1) ��ѧ��Ӧ���ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣻
(2)���ݵ���غ�������
(3)�ٸ��ݳ����ܽ�ƽ��������ڴӳ����ܽ�ƽ��ƽ�ⳣ��������
(4)����������������Ӧ���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ����ϵ���غ��֪��ͬʱ���������ӣ�
��������������Ӧ��2H++2e-=H2��������n=![]() �������������ʵ�����ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ����ݵ���ת���غ���������ӵ����ʵ�����
�������������ʵ�����ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ����ݵ���ת���غ���������ӵ����ʵ�����
(1) N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol������ѧ��Ӧ���ʱ�=��Ӧ������ܺ�������������ܺͣ����Կɵã�-93kJ/mol=945kJ/mol+3��436kJ/mol-6��a�����a=391kJ/mol��
2NH3(g) ��H=��93kJ/mol������ѧ��Ӧ���ʱ�=��Ӧ������ܺ�������������ܺͣ����Կɵã�-93kJ/mol=945kJ/mol+3��436kJ/mol-6��a�����a=391kJ/mol��
(2)���ݵ���غ�ɵã�c(H+)+c(NH4+)=c(OH-)+c(Cl-)��������Һ��c(NH4+)=c(Cl-)������c(H+)=c(OH-)����Һ�����ԣ������£�Kw=10-14��c(OH-)=10-7mol/L�������Һ��c(NH3��H2O)=![]() ��c(NH4+)=c(Cl-)=
��c(NH4+)=c(Cl-)=![]() ��10-2mol/L�����Ը�һˮ�ϰ��Ļ�ѧƽ�ⳣ��Kb=
��10-2mol/L�����Ը�һˮ�ϰ��Ļ�ѧƽ�ⳣ��Kb=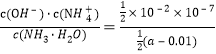 =
=![]() ��
��
(3)��BaSO4����Һ�д��ڳ����ܽ�ƽ�⣺BaSO4(s)![]() Ba2+(aq)+SO42-(aq)������Һ�м���Na2SO4��Һ����Һ��c(SO42-)������ƽ���ƶ�ԭ����֪����ƽ�������ƶ������ﵽƽ��ʱ����Һ��c(Ba2+)��С��
Ba2+(aq)+SO42-(aq)������Һ�м���Na2SO4��Һ����Һ��c(SO42-)������ƽ���ƶ�ԭ����֪����ƽ�������ƶ������ﵽƽ��ʱ����Һ��c(Ba2+)��С��
������ó����ܽ�ƽ���мӸ���Ĺ���BaSO4�������¶Ȳ��䣬�������ӵ�Ũ�Ȳ��䣬����c(Ba2+)��Ũ�Ȳ��䣻
(4)����������������Ӧ���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ����ϵ���غ��֪��ͬʱ���������ӣ������缫��ӦʽΪ��Cl--5e-+2H2O=ClO2��+4H+��
������������2H++2e--=H2�������������ʵ���Ϊn(H2)=![]()
ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ��ʽ���Ĥ�������ӵ����ʵ���Ϊ0.005mol��2=0.01mol��