题目内容
4.用化学方程式或离子方程式解释下列现象:(1)实验室中盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:请写出该原理的化学方程式:2NaOH+SiO2═Na2SiO3+H2O
(2)Cl2通入FeCl2溶液中可将Fe2+氧化,请写出该反应的离子方程式:Cl2+2Fe2+=2Fe3++2Cl-.
分析 (1)根据题意,实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,两者反应生成硅酸钠和水,写出反应的化学方程式即可;
(2)Cl2能将Fe2+氧化为Fe3+,自身被还原为Cl-,根据得失电子数守恒写出离子方程式.
解答 解:(1)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,两者反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2═Na2SiO3+H2O.
故答案为:2NaOH+SiO2═Na2SiO3+H2O;
(2)Cl2能将Fe2+氧化为Fe3+,自身被还原为Cl-,根据得失电子数守恒可知,1mol氯气能氧化2molFe2+,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:Cl2+2 Fe2+=2Fe3++2Cl-.
点评 本题考查离子方程式的书写,题目难度不大,注意从得失电子数守恒、电荷守恒和质量守恒等角度分析离子方程式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列变化中,一定不存在化学能与热能相互转化的是( )
| A. | 铁丝燃烧 | B. | 白磷自燃 | C. | 燃放爆竹 | D. | 干冰气化 |
15.现代科学又发现了H3、C60、C90、C240、N5、N60 …,据此可做出的推测是( )
①同一种元素可以形成多种单质
②单质可能存在复杂的分子结构
③单质的研究具有广阔的前景
④同种元素形成的单质之间可能存在更多的互相转化.
①同一种元素可以形成多种单质
②单质可能存在复杂的分子结构
③单质的研究具有广阔的前景
④同种元素形成的单质之间可能存在更多的互相转化.
| A. | 只有①② | B. | 只有②③ | C. | 只有③④ | D. | ①②③④ |
12.某些芳香族化合物与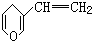 互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )
互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )
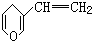 互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )
互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )| A. | 2种和1种 | B. | 2种和3种 | C. | 3种和2种 | D. | 3种和1种 |
16.今年是我国科学家成功合成牛胰岛素50周年.1965年,中国科学院上海生物化学研究所、北京大学和的科学家通力合作在世界上第一次用人工方法合成出具有生物活性的蛋白质--结晶牛胰岛素.下列有关说法不正确的是( )
| A. | 人工牛胰岛素的合成,标志着人类在化学合成技术上迈出了重要的一步 | |
| B. | 牛胰岛素的水溶液可产生丁达尔效应 | |
| C. | 结晶牛胰岛素合成之前,应先确定每条链上氨基酸的排列顺序 | |
| D. | 结晶牛胰岛素双链之间通过肽键联接 |
13.同位素示踪法可用于反应机理的研究.下列反应同位素示踪表示正确的是( )
| A. | 2CH3CH2OH+${\;}_{\;}^{18}$O2$→_{□}^{Cu}$2CH3CH${\;}_{\;}^{18}$O+2H2O | |
| B. | CH3COOC2H5+H2${\;}_{\;}^{18}$O$→_{□}^{H+}$CH3COOH+CH3CH2${\;}_{\;}^{18}$OH | |
| C. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4=K2SO4+2KMnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| D. | 2Na2${\;}_{\;}^{18}$O2+2H2O=4Na${\;}_{\;}^{18}$OH+O2↑ |