��Ŀ����
8��C��N��S��Cl��Mg��Al��Cr��Cu�dz�����Ԫ�أ���1��Alλ��Ԫ�����ڱ��������ڵڢ�A�壻Cr�Ļ�̬ԭ�Ӻ�����6��δ�ɶԵ��ӣ�S�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p4��
��2�����Ͳ���C3N4�����۵�ܸߣ�Ӳ�ȿ�����ʯ���������侧������Ϊԭ�Ӿ��壻��H-C��H-N���ֹ��ۼ��У����ļ��Խ�ǿ����H-N��Mg��Al����Ԫ���У�ԭ�Ӱ뾶�ϴ����Mg��
��3��ֱ�Ӽ���MgCl2•6H2O����ֻ�ܵõ�Mg��OH��Cl���壬�÷�Ӧ�Ļ�ѧ����ʽ��MgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$Mg��OH��Cl+HCl��+5H2O����Ϊ���ܵõ���ˮMgCl2������HCl���ѧʽ�������м��ȣ�
��4��S��Cu�ܷ������Ϸ�Ӧ����֪ת��0.1mol����ʱ����9.56kJ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��2Cu��s��+S��s��=Cu2S��s����H=-191.2kJ•mol-1��
���� ��1��AlԪ��λ��Ԫ�����ڱ��������ڵڢ�A�壻Cr�Ļ�̬�۵��Ӻ�������Ų�ʽΪ3d54s1��Sԭ�Ӻ�����ӻ�̬�Ų�ʽΪ1s22s22p63s23p4��
��2���������Ͳ���C3N4�����۵�ܸߣ�Ӳ�ȿ�����ʯ�������жϣ����ļ��Ժ�����ԭ�ӵĵõ���������أ��õ�����������ǿ�����ݵ��Ӳ�����ͬ���˵����Խ��뾶ԽС�Ƚ�Mg��Al��ԭ�Ӱ뾶��С��
��3��ֱ�ӽ�MgCl2•6H2O��ǿ��ֻ�ܵõ�Mg��OH��Cl���壬ͬʱ������HCl��ˮ�������Ȼ�þ��ˮ�⣬Ϊ��ֹ�Ȼ�þˮ�⣬����ȡ�Ȼ�þʱ��Ҫ��MgCl2•6H2O�����Ȼ��������У�
��4����һ�������£�S��Cu�ܷ������Ϸ�Ӧ����Ӧ����ʽΪ��2Cu+S=Cu2S����Ӧʱ��ÿת��0.1mol����ʱ����9.56kJ����μӷ�Ӧ1molSת��2mol���ӣ����Է���ΪΪ9.56kJ��$\frac{2mol}{0.1mol}$=191.2KJ���ݴ���д��
��� �⣺��1��AlԪ��λ��Ԫ�����ڱ��������ڵڢ�A�壻Cr�Ļ�̬�۵��Ӻ�������Ų�ʽΪ3d54s1����6��δ�ɶԵ��ӣ�Sԭ�Ӻ��������Ϊ16��������ӻ�̬�Ų�ʽΪ1s22s22p63s23p4��
�ʴ�Ϊ��������A��6��1s22s22p63s23p4��
��2�����Ͳ���C3N4�����۵�ܸߣ�Ӳ�ȿ�����ʯ����������þ���Ϊԭ�Ӿ��壻���ļ��Ժ�����ԭ�ӵĵõ���������أ��õ�����������ǿ����H-N�ļ���ǿ��H-C���ֵ��Ӳ�����ͬ���˵����Խ��뾶ԽС������Mg��Al����Ԫ���У�ԭ�Ӱ뾶�ϴ��Mg���ʴ�Ϊ��ԭ�Ӿ��壻H-N��Mg��
��3��ֱ�ӽ�MgCl2•6H2O��ǿ��ֻ�ܵõ�Mg��OH��Cl���壬ͬʱ������HCl��ˮ��������Ӧ����ʽΪMgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$Mg��OH��Cl+HCl��+5H2O�����Ȼ�þ��ˮ�⣬Ϊ��ֹ�Ȼ�þˮ�⣬����ȡ�Ȼ�þʱ��Ҫ��MgCl2•6H2O�����Ȼ��������У��ʴ�Ϊ��MgCl2•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$Mg��OH��Cl+HCl��+5H2O����HCl��
��4����һ�������£�S��Cu�ܷ������Ϸ�Ӧ����Ӧ����ʽΪ��2Cu+S=Cu2S����Ӧʱ��ÿת��0.1mol����ʱ����9.56kJ����μӷ�Ӧ1molSת��2mol���ӣ����Է���ΪΪ9.56kJ��$\frac{2mol}{0.1mol}$=191.2KJ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�2Cu��s��+S��s��=Cu2S��s����H=-191.2 kJ•mol-1��
�ʴ�Ϊ��2Cu��s��+S��s��=Cu2S��s����H=-191.2 kJ•mol-1��
���� ���⿼��֪ʶ��϶࣬�漰ԭ�ӽṹ��Ԫ�������ɵıȽϡ���Ӧ�ȵļ���ͷ���ʽ����д��Ϊ�߿��������ͣ�������ѧ�����������������Ƚ�������������

 Ŀ�����ϵ�д�
Ŀ�����ϵ�д�| A�� | �˹�ţ�ȵ��صĺϳɣ���־�������ڻ�ѧ�ϳɼ�������������Ҫ��һ�� | |
| B�� | ţ�ȵ��ص�ˮ��Һ�ɲ��������ЧӦ | |
| C�� | �ᾧţ�ȵ��غϳ�֮ǰ��Ӧ��ȷ��ÿ�����ϰ����������˳�� | |
| D�� | �ᾧţ�ȵ���˫��֮��ͨ���ļ����� |
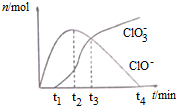
| A�� | t1ʱ����Һ��Na+��NH4+��CO32-��S2-���Դ������� | |
| B�� | t2ʱ����Һ�к�����Ũ�ȴ�С��c��ClO-����c��Cl-����c��ClO3-�� | |
| C�� | t3ʱ�����ӷ���ʽΪ��4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D�� | t4ʱ����c��ClO-���ӽ���0������c��ClO3-��=c��Cl-�� |
| A�� | 2CH3CH2OH+${\;}_{\;}^{18}$O2$��_{��}^{Cu}$2CH3CH${\;}_{\;}^{18}$O+2H2O | |
| B�� | CH3COOC2H5+H2${\;}_{\;}^{18}$O$��_{��}^{H+}$CH3COOH+CH3CH2${\;}_{\;}^{18}$OH | |
| C�� | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4=K2SO4+2KMnSO4+5${\;}_{\;}^{18}$O2��+8H2O | |
| D�� | 2Na2${\;}_{\;}^{18}$O2+2H2O=4Na${\;}_{\;}^{18}$OH+O2�� |
| A�� | ��Ӧ��̬�⻯����ȶ���M��R | B�� | RԪ�ص��������һ��Ϊ+7�� | ||
| C�� | ���Ӱ뾶��M2-��R-��N2+ | D�� | ��ԭ�ԣ�M2-��R- |
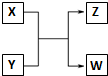 ��֪X��Y��Z��W�ֱ����ɶ�����Ԫ����ɵ�������������֮������ͼ��ʾ��ת����ϵ����X��һ�ֺ���18���ӵ�����Z��һ�ֺ���10���ӵ�������ش��������⣺
��֪X��Y��Z��W�ֱ����ɶ�����Ԫ����ɵ�������������֮������ͼ��ʾ��ת����ϵ����X��һ�ֺ���18���ӵ�����Z��һ�ֺ���10���ӵ�������ش��������⣺
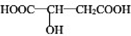 ����������ˮ���ǹ������Ӽ���
����������ˮ���ǹ������Ӽ���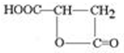 ��
��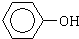 ��CH2=CH2��CH��CH ��
��CH2=CH2��CH��CH �� ��
��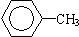 ��
��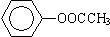 ��CH3CH2CH2CH2Br
��CH3CH2CH2CH2Br