题目内容
13.向由Cu、Cu2O和CuO组成的混合物中,加入10mL 6mol•L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224mL.请回答以下问题:(1)写出Cu2O与稀硝酸反应的离子方程式3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O.
(2)产物中硝酸铜的物质的量为0.025mol.
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为0.005mol,CuO的物质的量为0.005mol.
分析 硝酸与Cu、Cu2O和CuO组成的混合物恰好反应,生成Cu(NO3)2与NO,根据n=$\frac{V}{Vm}$计算NO的物质的量,根据n=cV计算硝酸的物质的量,根据氮元素守恒可知n[Cu(NO3)2]=$\frac{1}{2}$[n(HNO3)-n(NO)],根据电子转移守恒有2n(Cu)+2n(Cu2O)=3n(NO),据此计算n(Cu2O),再根据铜元素守恒可知n(CuO)=n[Cu(NO3)2]-n(Cu)-2n(Cu2O),根据m=nM计算Cu2O与CuO的质量,进而计算二者的物质的量.
解答 解:(1)Cu2O与稀硝酸反应+1价的铜被氧化,而+5价的氮被还原,离子方程式为3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O,故答案为:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O;
(2)标准状况下224mLNO气体的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,硝酸与Cu、Cu2O和CuO组成的混合物恰好反应,生成Cu(NO3)2与NO,根据氮元素守恒可知n[Cu(NO3)2]=$\frac{1}{2}$[n(HNO3)-n(NO)]=$\frac{1}{2}$(0.1L×0.6mol/L-0.01mol)=0.025mol,故答案为:0.025mol;
(3)根据电子转移守恒有2n(Cu)+2n(Cu2O)=3n(NO),故0.01mol×2+2n(Cu2O)=3×0.01mol,解得n(Cu2O)=0.005mol,
根据铜元素守恒可知n(CuO)=n[Cu(NO3)2]-n(Cu)-2n(Cu2O)=0.025mol-0.01mol-2×0.005=0.005mol,
故答案为;0.005mol; 0.005mol.
点评 本题考查混合物的有关计算,利用常规方法无法解答,注意利用原子守恒与电子转移守恒解答,难度中等,是对学生分析、思维能力的考查.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | PH>7的溶液中:K+、AlO2-、Cl-、SO42- | |
| B. | 含有0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、SCN-、HCO3- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 在由水电离产生c(H+)=1×10-13mol/L的溶液中:Na+、S2O32-、Fe3+、NO3- |
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: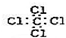 |
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
. .
.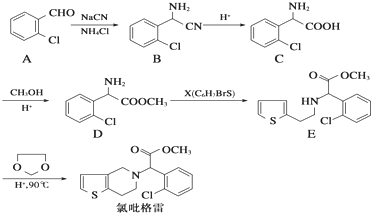 ,
, .
.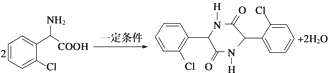 .
.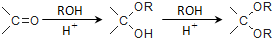 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物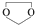 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物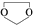 的最后一步反应
的最后一步反应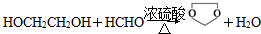 .
.