题目内容
18.有下列物质(以下每空均填序号)①MgCl2 ②干冰 ③${\;}_{17}^{37}$Cl ④NaOH⑤O2 ⑥${\;}_{17}^{35}$Cl ⑦Na2CO3 ⑧金刚石 ⑨O3 ⑩SiO2
(1)以上物质中属于离子晶体的是①④⑦;
(2)属于分子晶体的是②⑤⑨.
(3)属于原子晶体的是⑧⑩.
(4)互为同素异形体的有⑤⑨.
(5)属于同位素的有③⑥.
(6)含共价键的是②④⑤⑦⑧⑨⑩.
分析 (1)由阴阳离子按照一定的比例通过离子键结合而成的晶体,强碱、活泼金属氧化物、大多数的盐属于离子晶体;
(2)分子之间通过分子间作用力形成的晶体为分子晶体;
(3)原子间通过共价键结合形成的晶体为原子晶体;
(4)同种元素形成的结构不同的单质,互为同素异形体;
(5)质子数相同,中子数不同的同种元素的不同核素互为同位素;
(6)非金属元素原子之间容易形成共价键.
解答 解:(1)①MgCl2 ④NaOH ⑦Na2CO3 都是由阴阳离子通过离子键形成晶体属于离子晶体;
故答案为:①④⑦;
(2)②干冰⑤O2 ⑨O3 分别是由二氧化碳、氧气、臭氧分子组成的分子晶体;
故答案为:②⑤⑨;
(3)⑧金刚石是由碳原子通过共价键形成原子晶体;⑩SiO2是由硅原子和氧原子通过共价键形成原子晶体;
故答案为:⑧⑩;
(4)⑤O2 和⑨O3 同种元素形成的结构不同的单质,互为同素异形体;
故答案为:⑤⑨;
(5)③${\;}_{17}^{37}$Cl 和⑥${\;}_{17}^{35}$Cl 是质子数相同,中子数不同的同种元素的不同核素互为同位素;
故答案为:③⑥;
(6)②干冰中的C=O键属于共价键;④NaOH中氧原子与氢原子之间存在H-O共价键;⑤O2 存在O=O共价键; ⑦Na2CO3 碳酸根离子内存在C-O共价键;⑧金刚石存在C-C共价键;⑨O3氧原子之间存在共价键; ⑩SiO2存在Si-O共价键;
故答案为:②④⑤⑦⑧⑨⑩.
点评 本题考查了晶体类型、同位素、同素异形体的概念的判断,共价键、离子键的判断,熟悉相关概念是解题关键,侧重考查学生对基础知识的掌握,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的( )
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
9.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
6.使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是( )
| A. | 5mol | B. | 4.5mol | C. | 5.5mol | D. | 6mol |
3.砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是( )
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外层有7个电子 | D. | 砹易溶于水,难溶于四氯化碳 |
7.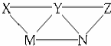 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
 KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )| A. | X可能为KHSO4 | B. | M不可能是BaCl2 | C. | Y一定为Na2CO3 | D. | N可能是FeSO4 |
8.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有( )
| A. | NaNO2 NO H2O | B. | NaNO3 NaOH O2 H2O | ||
| C. | NaNO3 H2O | D. | NaNO3 HNO3 O2 H2O |