��Ŀ����
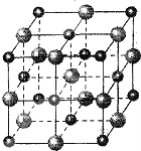
����Ŀ����һ����ʶ������ԭ��Ӧ���Ȼ�刺ɳ�ȥͭ�����������ͭ��![]()
��1��������ԭ��Ӧ��ʵ����__________����д��ţ���
A��������ʧ�� B�����ϼ۵����� C���������������� D�����ӵĵ�ʧ��ƫ��
��2���õ����ű��������Ӧ�е���ת�Ƶķ������Ŀ________��
��3��������Ӧ�У��Ȼ����N�Ļ��ϼ�_______������������������������_____������������ʧ�������ӣ���____������������������ԭ������������_____����������������ԭ�����ԣ�����____����������������ԭ������Ӧ��
��4���������ͻ�ԭ�����ʵ���֮����___��
��5��������![]() 11.2 L����״����ʱ��ת��___�����ӣ�����ԭ��CuO__mol��
11.2 L����״����ʱ��ת��___�����ӣ�����ԭ��CuO__mol��
���𰸡�D 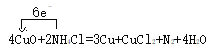 ���� ʧ ��ԭ�� ��ԭ ���� 3��2 3NA 1.5
���� ʧ ��ԭ�� ��ԭ ���� 3��2 3NA 1.5
��������
������ԭ��Ӧ�ı���Ϊ���ӵ�ת�ƣ���ʧ��ƫ�ƣ�����������Ԫ�ػ��ϼ۵ı仯��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�CuO�е�ͭԪ����+2�۽��͵�0�ۣ�������ԭ��Ӧ������������NH4Cl�е�Ԫ����-3�����ߵ�0�ۣ�����������Ӧ������ԭ��������ת�Ƽ���ظ����Ĺ�ϵΪ��6e----N2��3CuO(����ԭ)���ݴ˽��м��㡣
��1��������ԭ��Ӧ�ı���Ϊ���ӵ�ת�ƣ���ʧ��ƫ�ƣ�����������Ԫ�ػ��ϼ۵ı仯��
�ʴ�ѡD��
��2��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�CuO��Cu��ͭԪ����+2�۽��͵�0�ۣ��õ�2�����ӣ�3molCuO��3Cu�����õ�����6mol���ӣ�����Ӧת�Ƶĵ���Ϊ6mol�� �����ű��������Ӧ�е���ת�Ƶķ������Ŀ���£�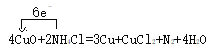 ��
��
�ʴ��ǣ�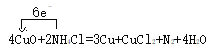 ��
��
��3��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У��Ȼ���е�Ԫ����-3�����ߵ�0�ۣ�ʧ���ӣ�����������Ӧ������ԭ�������ֻ�ԭ�ԣ�
�ʴ��ǣ����ߣ�ʧ����ԭ������ԭ��������
��4��4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O��Ӧ�У�NH4Cl����ԭ����ȫ�������������Ի�ԭ����2mol��4molCuO����3molCuO����ԭ�����������������������ͻ�ԭ�����ʵ���֮����3mol��2mol=3:2��
�ʴ��ǣ�3:2��
��5������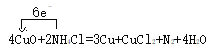 ��֪��6e----N2��3CuO(����ԭ)�����Ե���������Ϊ11.2L/22.4L/mol=0.5molʱ��ת��3mol���ӣ�����Ϊ3NA������ԭ��CuOΪ1.5mol��
��֪��6e----N2��3CuO(����ԭ)�����Ե���������Ϊ11.2L/22.4L/mol=0.5molʱ��ת��3mol���ӣ�����Ϊ3NA������ԭ��CuOΪ1.5mol��
�ʴ��ǣ�3NA��1.5��

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�����Ŀ����¯���������з�����Ӧ��![]() Fe2O3(s)��CO(g)
Fe2O3(s)��CO(g) ![]()
![]() Fe(s)��CO2(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��������
Fe(s)��CO2(g)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ��������
�¶�T/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ��K | 4.0 | 3.7 | 3.5 |
����˵����ȷ����
A. ���Ӹ�¯�ĸ߶ȿ�����Ч��������β����CO�ĺ���
B. �ɱ������ݿ��жϸ÷�Ӧ����Ӧ������������������������
C. Ϊ��ʹ�÷�Ӧ��K��������������������ʱ������c(CO)
D. 1000����Fe2O3��CO��Ӧ��t min�ﵽƽ��ʱc(CO) =2��10-3 mol/L������CO��ʾ�÷�Ӧ��ƽ������Ϊ![]() mol/(L��min)
mol/(L��min)
����Ŀ��KIO3 ��һ����Ҫ�������������Ϊʳ���еIJ������������KClO3 ���������Ʊ� KIO3 ������������ͼ��ʾ���ش��������⣺

(1)���ữ��Ӧ�����ò����� KH(IO3)2��Cl2 �� KCl������ Cl2�����õķ�����________��
(2)����Һ���е�������Ҫ��_______������ pH���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________��
(3)�ᾧ����ʱ���˷��� KH(IO3)2 Ϊ������״���������¿��Բ��õķ�����________��
A�������� B.�ؽᾧ�� C.���˷� D. ���ķ��뷨
(4)�����У����ʡȥ���ữ�����������������ᾧ�١�������������������ֱ�����Լ� X ������Ӧ����Һ�� pH���������������ʲô����Ӱ��_________________________________________________________________��
(5)KIO3 Ҳ�ɲ�������ⷨ���Ʊ���װ����ͼ��ʾ��������ⷨ����ȣ���KClO3 ������������Ҫ����֮����_____________________________________��(д��һ��)

(6)��֪��KIO3��5KI��3H2SO4=3K2SO4��3I2��3H2O��I2��2S2O32-=2I����S4O62-���ⶨ�ӵ�ʳ���е�ĺ�����ѧ������Ƶ�ʵ�鲽�����£�
a��ȷ��ȡ w g ʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b����ϡ�����ữ������Һ��������� KI ��Һ��ʹ KIO3 �� KI ��Ӧ��ȫ��
c���Ե���Ϊָʾ�����������ʵ���Ũ��Ϊ2.0��10-3mol��L-1 �� Na2S2O3 ��Һ 10.0mL ǡ�÷�Ӧ�� ��ӵ�ʳ����Ʒ�еĵ�Ԫ�غ�����______________mg/kg��(�Ժ� w �Ĵ���ʽ��ʾ)
(7)ѧ�����ֶԴ����� NaCl(���� KIO3)����������ʵ�飺
�������� | ʵ������ |
ȡ 1g ������ NaCl���� 3mL ˮ�����Һ�� | ��Һ�ޱ仯 |
���� 5 �ε�����Һ�� 1mL 0.1 mol��L��1KI ��Һ���� | ��Һ�ޱ仯 |
Ȼ���ٵ��� 1 �� 1mol��L��1 �� H2SO4���� | ��Һ����ɫ |
����ѧ���ҵ�ʵ���������ѧ����ʵ����������Ҫ����___________________________��
����Ŀ���Ҷ����������ᣬ������ˮ��Ϊ�˲ⶨ���ᾧ��H2C2O4��xH2O�е�xֵ��ijʵ��С�����ʵ�飬�������£�
�ٳ�ȡ1.260g���ᾧ�壬���100mL��Һ��
��ȡ25.00mL��H2C2O4��Һ������ƿ�ڣ��ټ�������ϡ���ᡣ
����Ũ��Ϊ0.1000mol/L��KMnO4����Һ���еζ������ζ��ﵽ�յ㡣
���ظ�ʵ�顣��¼�����������£�
ʵ����� | V(KMnO4��Һ) | |
�ζ�ǰ�̶�/mL | �ζ���̶�/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
�ش��������⣺
(1)�Ҷ����KMnO4����Һ��Ӧ�����ӷ���ʽΪ____________
(2)�������Ҫʹ���ձ�����Ͳ������������ͷ�ιܣ���ȱ�ٵIJ�������Ϊ_______(������)������۵ζ������У�ʢװKMnO4��Һ������Ϊ__________________(������)��
(3)��ʵ��ζ��ﵽ�յ�ı�־��__________________________;
(4)�������ݣ�����H2C2O4��Һ�����ʵ���Ũ��Ϊ______mol/L��x=____________��
(5)���ζ��յ�ʱ���ӵζ��̶ܿȣ���xֵ��_____________(����ƫ��������ƫС������������) ��