题目内容
【题目】高氯酸铵NH4ClO4是复合火箭推进剂的重要成分,实验室可通过下列反应制取
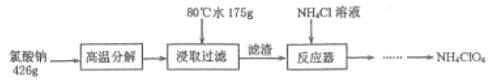
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________________________。
(2)反应得到的混合溶液中 NH4ClO4 和 NaCl 的质量分数分别为 0.30 和 0.15, 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)_______、______、 _______、冰水洗涤、干燥。用冰水洗涤的目的是___________________________________________________。若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是_____________。
(3) 样品中NH4ClO4的含量可用蒸馏法进行则定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
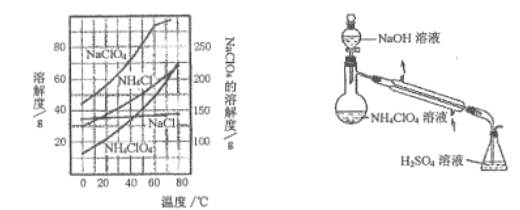
步骤1: 按上图所示组装仪器,检查装置气密性。
步骤2: 准确称取样品a g 于蒸馏烧瓶中,加入150mL 水溶解。
步骤3: 准确量取40.00mL、0.1000mol/L H2SO4溶解于锥形瓶中。
步骤4: 经分液漏斗向蒸馏瓶中加入20.00mL、3mol /LNaOH 溶液。
步骤5: 加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6: 用新煮沸过的水冲洗冷凝装置2--3 次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol/L NaOH 标准溶液滴定剩余H2SO4至终点时消耗NaOH 标准溶液VmL。
①步骤3 中,准确量取40.00mL.H2SO4溶液的玻璃仪器是___________。
②样品中NH4ClO4的质量分数为_______。若取消步骤6,则对定结果的影响是______(填“偏高”、“偏低”或“无影响”)。
【答案】 4NaClO3![]() NaCl 3NaClO4 蒸发浓缩 冷却结晶 过滤 减少洗涤过程中 NH4ClO4晶体的损失 氨气与浓盐酸反应放出热量 酸式滴定管
NaCl 3NaClO4 蒸发浓缩 冷却结晶 过滤 减少洗涤过程中 NH4ClO4晶体的损失 氨气与浓盐酸反应放出热量 酸式滴定管 ![]() 偏低
偏低
【解析】根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,过滤洗涤干燥就可以得到高氯酸铵的固体。
(1)根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,得到方程式为4NaClO3![]() 3NaClO4+NaCl,故答案为:4NaClO3
3NaClO4+NaCl,故答案为:4NaClO3![]() 3NaClO4+NaCl;
3NaClO4+NaCl;
(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故从混合溶液中获得较多NH4ClO4晶体的实验操作依次为:蒸发浓缩,冷却结晶,过滤,用冰水洗涤,可以减少洗涤过程中 NH4ClO4晶体的损失;氨气与浓盐酸反应放出热量,反应需要温度较低,故NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,故答案为:蒸发浓缩,冷却结晶;过滤;减少洗涤过程中 NH4ClO4晶体的损失;氨气与浓盐酸反应放出热量;
(3)①量取40.00mLH2SO4溶液的玻璃仪器为酸式滴定管,故答案为:酸式滴定管;
②NH4ClO4与氢氧化钠反应生成的氨气被硫酸吸收,剩余硫酸用氢氧化钠滴定,消耗的氢氧化钠的物质的量为cmol/L×V×10-3L=cV×10-3 mol,因此与氢氧化钠反应的硫酸为![]() mol,则NH4ClO4的物质的量为2×(0.0400L×0.1000mol/L-
mol,则NH4ClO4的物质的量为2×(0.0400L×0.1000mol/L-![]() mol)=2×(0.00400-
mol)=2×(0.00400-![]() )mol,因此样品中NH4ClO4的质量分数为
)mol,因此样品中NH4ClO4的质量分数为![]() ×100%=
×100%=![]() %,若取消步骤6,部分氨气未被硫酸吸收,导致V偏大,则
%,若取消步骤6,部分氨气未被硫酸吸收,导致V偏大,则![]() %偏低,故答案为:
%偏低,故答案为:![]() %;偏低。
%;偏低。

 快捷英语周周练系列答案
快捷英语周周练系列答案