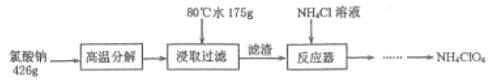
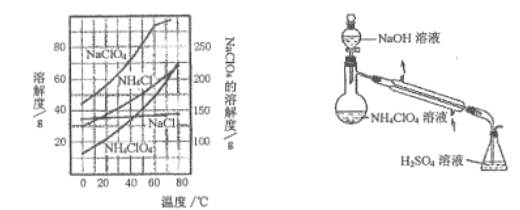
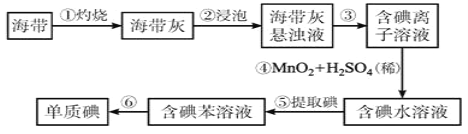
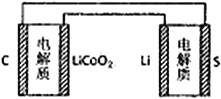
题目内容
【题目】写出下列反应的化学方程式:
如下图,A是单质,B为淡黄色固体。
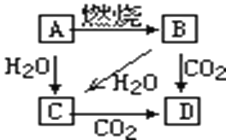
写出下列转化的化学方程式为:
(1)A→ B______________________________
(2)B→ D______________________________
(3)B→ C______________________________
(4)A→C_______________________________
(5)A与硫酸铜溶液反应_________________________________
【答案】2Na+O2![]() Na2O2;2Na2O2+2CO2=2 Na2CO3+ O22Na2O2+2 H2O =4NaOH+ O2↑2Na +2H2O =2NaOH + H2 ↑2Na+CuSO4+2H2O =Cu(OH)2↓+ Na2SO4+ H2 ↑
Na2O2;2Na2O2+2CO2=2 Na2CO3+ O22Na2O2+2 H2O =4NaOH+ O2↑2Na +2H2O =2NaOH + H2 ↑2Na+CuSO4+2H2O =Cu(OH)2↓+ Na2SO4+ H2 ↑
【解析】
A是单质,B为淡黄色固体,A燃烧生成B,则B为Na2O2,A为Na,金属钠与水反应生成NaOH,则C为NaOH,D为Na2CO3,(1)2Na+O2![]() Na2O2;(2)2Na2O2+CO2=2Na2CO3+O2;(3)2Na2O2+2H2O=4NaOH+O2↑;(4)2Na+2H2O=2NaOH+H2↑;(5)Na先于H2O反应,2Na+2H2O=2NaOH+H2↑,NaOH再与CuSO4反应,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,联立得出:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑。
Na2O2;(2)2Na2O2+CO2=2Na2CO3+O2;(3)2Na2O2+2H2O=4NaOH+O2↑;(4)2Na+2H2O=2NaOH+H2↑;(5)Na先于H2O反应,2Na+2H2O=2NaOH+H2↑,NaOH再与CuSO4反应,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,联立得出:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目