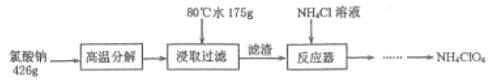
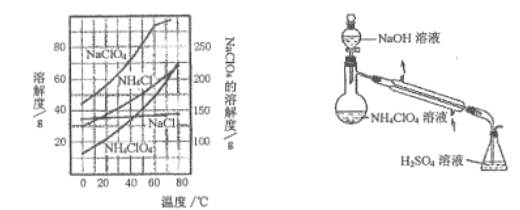
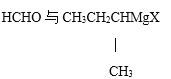题目内容
【题目】下列说法中,正确的是
A. 甲烷是一种清洁能源,是天然气的主要成分
B. 用KMnO4溶液浸泡过的藻土可使水果保鲜,是利用了乙烯的氧化性
C. 苯不能使KMnO4酸性溶液褪色,说明它是一种饱和烃,很稳定
D. 己烷可以使溴水褪色,说明己烷中含有碳碳双键
【答案】A
【解析】
A、天然气的主要成分是甲烷,它是一种“清洁能源”,甲烷在空气中完全燃烧生成二氧化碳和水,选项A正确;B、用KMnO4溶液浸泡过的藻土可使水果保鲜,是利用了乙烯的还原性,选项B错误;C、苯是一种不饱和烃,但苯不能使KMnO4酸性溶液褪色,选项C错误;D、己烷中不含碳碳双键,可以使溴水褪色是因为己烷萃取了溴水中的溴,选项D错误。答案选A。

【题目】下列有关物质检验的实验结论正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
A. A B. B C. C D. D
【答案】B
【解析】
白色沉淀可能为AgCl;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫;先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入具有氧化性的氯水,溶液变成红色,说明原溶液中一定存在亚铁离子;能使品红褪色的气体不一定为SO2;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫。
白色沉淀也可能为AgCl,若先加盐酸排除干扰,不生成沉淀,再加氯化钡生成沉淀,则溶液中一定含有SO42-,A错误;向某溶液中加入2滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子;再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后溶液中出现了铁离子,证明原溶液中一定含有Fe2+,B正确;能使品红褪色的气体不一定为SO2,也可能为其它强氧化性气体,如氯气、臭氧等,C错误;产生的气体能使澄清石灰水变浑浊,气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-、HCO3-,或SO32-、HSO3-,D错误。
【点睛】
本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握常见离子的检验、物质的性质、气体的检验等为解答的关键。
【题型】单选题
【结束】
17
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol