题目内容
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
【答案】C
【解析】解:A.由反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误;
CH3OCH3(g)+H2O(g)可知起始时CH3OH的浓度为0.44mol/L+2×0.6mol/L=1.64mol/L,故A错误;
B.反应到某时刻时浓度商Q= ![]() =
= ![]() =1.86<400,反应未达到平衡状态,向正反应方向移动,则正反应速率大于逆反应速率,故B错误;
=1.86<400,反应未达到平衡状态,向正反应方向移动,则正反应速率大于逆反应速率,故B错误;
C.设平衡时转化的浓度为x,则
2CH3OH(g) |
| CH3OCH3(g)+ | H2O(g) | |
起始: | 1.64mol/L | 0 | 0 | |
转化: | x | 0.5x | 0.5x | |
平衡: | 1.64mol/L﹣x | 0.5x | 0.5x |
则 ![]() =400,x=1.6mol/L,
=400,x=1.6mol/L,
平衡时CH3OH的浓度为1.64mol/L﹣1.6mol/L=0.04mol/L,故C正确;
D.平衡时CH3OH的转化率为 ![]() =97.6%,故D错误.
=97.6%,故D错误.
故选C.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
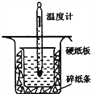
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差