题目内容
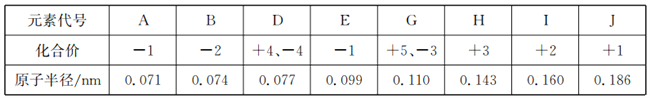
【题目】根据下表中几种短周期元素的原子半径及主要化合价,回答下列问题:
(1)元素D组成的常见单质有两种,分别是_______、________(写名称)。
(2)用电子式表示IE2的形成过程:_________________________。
(3)A、H、J的离子半径由大到小顺序是_________(用离子符号表示)。
(4)78 g J2B2与足量的水反应生成_______L(标准状况下)气体。
(5)元素E的单质与水反应的离子方程式为_______________。
【答案】 金刚石 石墨 ![]() r(F-)>r(Na+)>r(Al3+) 11.2 Cl2+H2O
r(F-)>r(Na+)>r(Al3+) 11.2 Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
【解析】主族元素中,元素最高化合价与其族序数相等,最大化合价=族序数-8,同一主族元素中,原子半径随着原子序数增大而增大,同一周期元素中,原子半径随着原子序数增大而减小;根据表中化合价及原子半径大小可知, A 、E均为-1价,为第VIIA族元素,A 的原子半径小于E,所以A为氟、E为氯;J、I、H原子半径比其它原子的原子半径大,且按顺序依次减小,所以根据其化合价规律可知,J为钠,I为镁,H为铝;B为-2价,半径较小,B为氧,G有+5、-3价,且半径较大,但是比J、 I、 H原子半径小,G为磷;D有 +4、 -4价,且半径比G小,因此D为碳;综上所述:A为 F,B为 O,D为C,E为 Cl,G为 P,H为 Al, I为 Mg, J为 Na;
(1)碳元素组成的常见单质有两种,分别是金刚石、石墨;正确答案:金刚石、石墨。
(2) I为 Mg、E为 Cl,二者形成氯化镁,属于离子化合物,电子式表示氯化镁的形成过程:![]() ;正确答案:
;正确答案:![]() 。
。
(3)核外电子排布相同的离子,核电荷数越大,离子半径越小,因此氟、钠、铝三种元素形成的简单离子,其离子半径由大到小顺序是:r(F-)>r(Na+)>r(Al3+);正确答案:r(F-)>r(Na+)>r(Al3+)。
(4) J2B2为过氧化钠,78 g过氧化钠为1mol,1mol过氧化钠与足量的水反应生成0.5mol氧气,标准状况下气体体积为0.5×22.4=11.2 L ;正确答案:11.2。
(5)元素E的单质为氯气,氯气与水反应生成盐酸和次氯酸,离子方程式为Cl2+H2O![]() H++Cl-+HClO;正确答案:Cl2+H2O
H++Cl-+HClO;正确答案:Cl2+H2O![]() H++Cl-+HClO。
H++Cl-+HClO。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案