题目内容
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
分析 A、求出丙烷的物质的量,然后根据1mol丙烷中含10mol共价键来分析计算;
B、溶液的体积不明确;
C、在NO2气体中存在平衡:2NO2?N2O4,导致气体体积偏小;
D、根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于1mol分析.
解答 解:A、17.6g丙烷的物质的量n=$\frac{17.6g}{44g/mol}$=0.4mol,而1mol丙烷中含10mol共价键,故0.4mol丙烷中含4mol共价键,故A正确;
B、溶液的体积不明确,故溶液中的氢氧根的个数无法计算,故B错误;
C、一氧化氮和氧气不需要任何条件即可反应,由2NO+O2═2NO2,分子数减少,即分子总数小于0.5NA,故C错误;
D、电解精炼铜时,若阳极质量减少64g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少64g,转移的电子的物质的量大于2mol,则阴极得到的电子数大于2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.x能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是( )
| A. | 最高价氧化物对应水化物的酸性:w>Z>x | |
| B. | 化合物Q中存在两种类型的共价键 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
14.下列离子方程式不正确的是( )
| A. | 纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O?HCO3-+OH- | |
| B. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-=H2O+CO32- | |
| C. | 硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO2↑ | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
1.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解 | |
| C. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| D. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 |
18.下列各组离子在特定条件下能够大量共存的是( )
| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→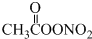 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )
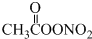 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
16.下列离子方程式正确的是( )
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |