题目内容
5.铋酸钠(NaBiO3)溶液呈无色.向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
分析 由①中现象可知:NaBiO3把Mn2+氧化生成MnO4-,则NaBiO3得电子作氧化剂,NaMnO4为氧化产物;
由②中现象可知:NaMnO4氧化H2O2产生O2,则NaMnO4为氧化剂,氧气为氧化产物;
由③中现象可知:碘离子被双氧水氧化成单质碘,则NaMnO4为氧化剂,碘单质为氧化产物,
结合氧化剂的氧化性大于氧化产物的氧化性这一规律来回答判断.
解答 解:氧化剂的氧化性大于氧化产物的氧化性,
由①中现象可知:NaBiO3把Mn2+氧化生成MnO4-,则NaBiO3(氧化剂)的氧化性强于NaMnO4(氧化产物)的氧化性;
由②中现象可知:NaMnO4氧化H2O2产生O2,自身被还原为Mn2+,则NaMnO4(氧化剂)的氧化性强于H2O2的氧化性;
由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性;
综上所述,NaBiO3、NaMnO4、I2、H2O2的氧化性由强到弱的顺序是:NaBiO3>NaMnO4>H2O2>I2,
故答案为:NaBiO3>NaMnO4>H2O2>I2.
点评 本题考查学生氧化还原反应中氧化性强弱的判断规律知识,注意氧化剂的氧化性强于氧化产物的氧化性这一规律是关键,难度不大.

练习册系列答案
相关题目
16.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.x能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是( )
| A. | 最高价氧化物对应水化物的酸性:w>Z>x | |
| B. | 化合物Q中存在两种类型的共价键 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
13.断裂1mol丙烷分子中所有共价键需要4006kJ的能量,而断裂1mol新戊烷分子中所有共价键需要6356kJ的能量.则C-C键的平均键能为( )
| A. | 347kJ/mol | B. | 368 kJ/mol | C. | 386 kJ/mol | D. | 414 kJ/mol |
20.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则不可能的情形是( )
| A. | 由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 由0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合而成 | |
| C. | 由0.1 mol/LCH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| D. | 向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
10.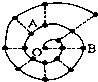 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
14.下列离子方程式不正确的是( )
| A. | 纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O?HCO3-+OH- | |
| B. | 烧碱溶液与小苏打溶液混合:OH-+HCO3-=H2O+CO32- | |
| C. | 硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO2↑ | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→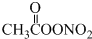 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )
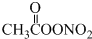 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
 如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.
如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.