题目内容
H2S水溶液中存在电离平衡H2S ?H++HS-和HS-
?H++HS-和HS- ?H++S2-。若向H2S溶液
?H++S2-。若向H2S溶液
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
练习册系列答案
相关题目
2.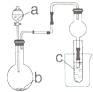 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
 实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )
实验室中部分气体的制取及性质实验装置如图所示(省略加持和净化装置)对c中现象判断正确的是( )| 选项 | 试剂a | 试剂b | 试剂c | c中的现象 |
| A | 浓氨水 | 生石灰 | 硝酸银溶液 | 先沉淀后消失 |
| B | 稀硝酸 | 银 | 水 | 试管口无明显现象 |
| C | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 溶液颜色没有变化 |
| D | 稀硫酸 | 纯碱 | 硅酸钠溶液 | 先沉淀后消失 |
| A. | A | B. | B | C. | C | D. | D |
碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
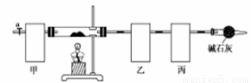
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
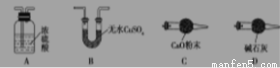
甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
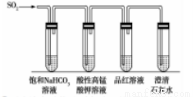
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
7.根据电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)═F-(aq)+H2 O(l)△H=-67.7kJ•
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.


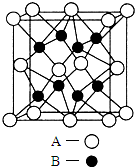 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题: 液pH=4
液pH=4
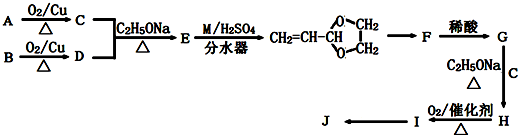
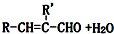
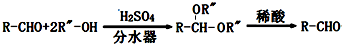
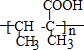 .
.