题目内容
【题目】下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是( )
A.FeCl2
B.AlCl3
C.FeCl3
D.CuCl2
【答案】B
【解析】解:A.FeCl2只能由Fe和盐酸反应生成,故A错误; B.AlCl3由可金属和氯气直接反应制得,又能由金属和盐酸反应制得,故B正确;
C.FeCl3只能由Fe和氯气反应生成,故C错误;
D.Cu为不活泼金属,与盐酸不反应,故D错误;
故选B.
【考点精析】解答此题的关键在于理解氯气的化学性质的相关知识,掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应.

【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
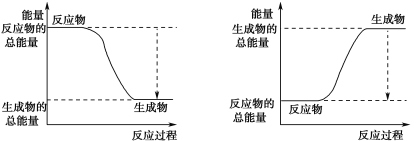
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体