题目内容
16.常温常压下,一种气态烷烃与一种气态烯烃的混和物共1L,完全燃烧后,恢复到原状况,得到1.2L二氧化碳.则该混和气体中一定含有( )| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 丙烯 |
分析 相同条件下,其体积之比等于其物质的量之比,根据原子守恒可知,混合物气体的平均分子式中含有1.2个碳原子,而碳原子数目小于1.2的烃只有甲烷,故一定含有甲烷,根据C原子守恒,可知烯烃碳原子数目应大于1.2,且满足气体即可.
解答 解:设烃的混合物平均分子组成为CxHy,根据体积之比等于物质的量之比,利用碳原子守恒,则x=1.2,所以混合物中烃分子中一定有含有1个碳原子的烃,由于混合物是烷烃和烯烃混合,烯烃至少2个碳原子,所以只能是烷烃含有1个碳原子,故烷烃为CH4,即混合物一定含有CH4,烯烃可能为乙烯、丙烯、丁烯等,
故选A.
点评 本题考查有机物分子式的确定、烃燃烧的有关计算,题目难度中等,关键根据碳原子平均量进行判断,注意掌握平均分子式法在确定有机物分子组成中的应用.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
7.在一定温度下,下列平衡体系颜色的变化不受压强变化影响的是( )
| A. | 2NO2(g)?N2O4 (g) | |
| B. | 2NO2(g)?2NO (g)+O2(g) | |
| C. | 2HI(g)?H2 (g)+I2(g) | |
| D. | FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq) |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 100mL0.1mol•L-1醋酸溶液含有的分子总数一定小于0.01NA |
11.下列关于离子检验的说法中,正确的是( )
| A. | 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32- | |
| B. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- | |
| C. | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| D. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
1.已知几种短周期元素的原子半径、常见的最高价和最低价如下表:
请回答下列问题:
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物 (用电子式表示)
(用电子式表示)
(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式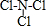 .
.
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物
 (用电子式表示)
(用电子式表示)(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式
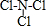 .
.
8. 可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )
可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )
 可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )
可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )| A. | 温度降低,化学平衡向逆方向移动 | |
| B. | 使用催化剂,D的物质的量分数增加 | |
| C. | 化学方程式系数m<r+q. | |
| D. | 物质B的颗粒越小,反应越快有利于平衡向正向中移动 |
5.取浓度相等的NaOH和HCl溶液,以3:2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为( )
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.05mol/L | D. | 0.50mol/L |
6.在元素周期表中,磷元素的某些信息如图所示.下列说法不正确的是( )
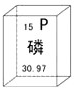

| A. | 磷元素为非金属元素 | B. | 磷原子核外有15个电子 | ||
| C. | 磷的原子序数为15 | D. | 相对原子质量为30.97g |
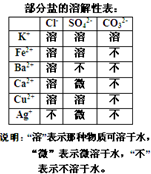 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验: