题目内容
【题目】元素周期表的一部分如图,请参照元素①~⑨在表中的位置,用化学用语回答下列问题: 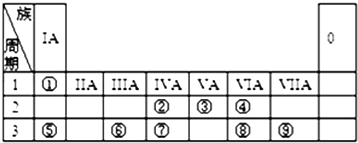
(1)已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为
(2)①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .
(3)⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .
(5)某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究. 
甲同学设计实验的依据是;其中装置B中所盛试剂的作用为;C中反应的离子方程式为 .
【答案】
(1)18g/mol
(2)Na>Al>C>H;HClO4>H2SO4>H2SiO3
(3)Al2O3+2NaOH═2NaAlO2+H2O
(4)![]() ;共价键
;共价键
(5)强酸制弱酸;除去CO2中的 HCl气体;SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣
【解析】解:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl.(1)②为C元素,其中子数为8的核素的质量数为14,其氢化物为甲为14CH4 , 摩尔质量为18g/mol,所以答案是:18g/mol;(2)所有元素中H原子半径最小,同主族自上而下原子半径增大,同周期自左而右原子半径减小,故原子半径:Na>Al>C>H;由于非金属性:Cl>S>Si,则酸性大小为:HClO4>H2SO4>H2SiO3 , 所以答案是:Na>Al>C>H; HClO4>H2SO4>H2SiO3;(3)⑥的最高价氧化物为Al2O3 , ⑤的最高价氧化物对应水化物为NaOH,二者反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
所以答案是:Al2O3+2NaOH═2NaAlO2+H2O;(4)元素④、⑤组成X,元素②、④形成Y,X与Y的反应是潜水艇和呼吸面具中氧气的来源,则X为Na2O2 , Y为CO2 , 二氧化碳分子中含有共价键,过氧化钠电子式为 ![]() ,
,
所以答案是: ![]() ;共价键;(5)根据装置可知,利用强酸制备弱酸判断元素非金属性,A中产生二氧化碳,B除去二氧化碳中HCl气体,C中是二氧化碳与硅酸钠反应生成硅酸与碳酸氢钠,反应方程式为:SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣ ,
;共价键;(5)根据装置可知,利用强酸制备弱酸判断元素非金属性,A中产生二氧化碳,B除去二氧化碳中HCl气体,C中是二氧化碳与硅酸钠反应生成硅酸与碳酸氢钠,反应方程式为:SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣ ,
所以答案是:强酸制弱酸;除去CO2中的HCl气体;SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣ .

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
