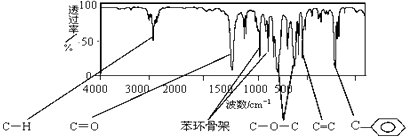
题目内容
【题目】M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37. 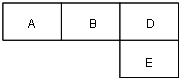
试回答:
(1)写出下列元素的符号: B:;N:
(2)D、E、N形成的简单离子的半径由大到小的关系是 . (写元素符号)
(3)由D、M形成的原子个数1:1的化合物所含的化学键类型是 , 写出该化合物的电子式 .
【答案】
(1)N;Na
(2)S2﹣>O2﹣>Na+
(3)共价键;![]()
【解析】解:(1)B元素的符号:N;N元素的符号:Na,所以答案是:N;Na;(2)电子层数越多半径越大,电子层数相同核电荷数越多半径越小,O、S、Na形成的简单离子的半径由大到小的关系是S2﹣>O2﹣>Na+ , 所以答案是:S2﹣>O2﹣>Na+;(3)由O、H形成的原子个数1:1的化合物是过氧化氢,过氧化氢中所含的化学键类型是共价键,过氧化氢的电子式 ![]() ,所以答案是:共价键;
,所以答案是:共价键; ![]() .
.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目