题目内容
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
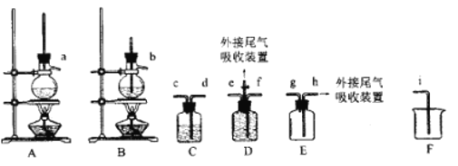
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
【答案】bdcefi NaOH 溶液 除去乙烯中混有的 SO2、CO2等酸性气体 乙醇 冷却后补加 A CH2 = CH2+ Br2→CH2BrCH2Br 发生取代反应同样可以使溴水褪色, 溴水中含有HBr 和 HBrO 等成分,不一定是 Br2发生加成反应 塑料瓶变瘪 石蕊溶液 溶液不变红(或硝酸酸化的硝酸银溶液,无淡黄色沉淀生成)
【解析】
用乙醇与浓硫酸作用制乙烯,需将浓硫酸加入乙醇中(相当于浓硫酸稀释),然后往混合液中加入碎瓷片(或沸石),以防暴沸;用温度计控制溶液温度在170℃左右,然后用酒精灯加热;由于浓硫酸会将乙醇氧化,生成CO2、SO2等气体,所以气体应先通过盛有碱液的洗气瓶,再用排水法收集,尾气用KMnO4酸性溶液处理。证明乙烯与溴发生的反应类型是加成反应还是取代反应,关键是证明产物中是否含有HBr。
(1)欲收集一瓶乙烯,需使用B、C、D、F装置,其连接顺序为bdcefi。答案为:bdcefi;
(2)C装置的作用是吸收乙烯中CO2、SO2等气体,盛放的试剂为NaOH 溶液,其作用为除去乙烯中混有的SO2、CO2等酸性气体。答案为:NaOH 溶液;除去乙烯中混有的SO2、CO2等酸性气体;
(3)由以上分析知,在烧杯中混合浓硫酸和乙醇时,应先添加乙醇;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为冷却后补加。答案为:乙醇;冷却后补加;
(4)因为浓硫酸、饱和Na2CO3溶液、NaOH溶液均不能吸收尾气,所以尾气吸收可采用KMnO4酸性溶液,故选A。答案为:A;
(5)乙烯与溴单质发生加成反应,生成BrCH2CH2Br,化学方程式为CH2= CH2+ Br2→BrCH2CH2Br。答案为:CH2= CH2+ Br2→BrCH2CH2Br;
(6)方案一中,不管是否发生加成反应,产物都为无色,所以不能证明乙烯与溴单质发生了加成反应,原因为发生取代反应同样可以使溴水褪色,溴水中含有HBr 和 HBrO 等成分,不一定是Br2发生加成反应。答案为:发生取代反应同样可以使溴水褪色, 溴水中含有HBr 和 HBrO 等成分,不一定是Br2发生加成反应;
(7)方案二中,由于塑料瓶内气体体积减小,瓶的体积也应减小,所以现象②应为塑料瓶变瘪,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充证明产物中不含有HBr的实验为:继续向方案二塑料瓶中加入少量石蕊溶液,振荡后,若溶液不变红(或硝酸酸化的硝酸银溶液,无淡黄色沉淀生成),证明发生了加成反应。答案为:塑料瓶变瘪;石蕊溶液;溶液不变红(或硝酸酸化的硝酸银溶液,无淡黄色沉淀生成)。

【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
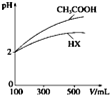
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中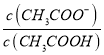 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。