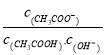题目内容
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
【答案】D
【解析】
①常温下,pH=1的强酸溶液,加水稀释后,溶液中H+浓度减小,而OH-浓度增大,①错误;
②pH=2的盐酸中c(H+)=10-2mol/L,pH=1的盐酸,c(H+)=10-1mol/L,二者c(H+)之比为1:10,②错误;
③当溶液pH相同时,碱的浓度小于盐的浓度,而且产生盐的相应的酸的酸性越弱,该盐的浓度就越小,由于酸性:CH3COOH>H2CO3>HClO,所以pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH的四种溶液物质的量浓度由小到大顺序为d<b<c<a,③正确;
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,根据电荷守恒,c(H+)+c(Na+)+c(NH4+)=2c(SO42-)+c(OH-),溶液pH=7,溶液显中性,c(H+)= c(OH-),则c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)<2c(SO42-),④错误;
⑤已知醋酸电离平衡常数为Ka,表示Ka=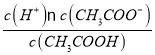 ,醋酸根水解常数为Kh;水的离子积为Kw, Kh=
,醋酸根水解常数为Kh;水的离子积为Kw, Kh=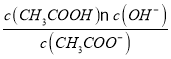 =
=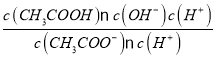 =
=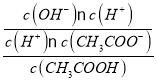 =
=![]() ,所以三者关系为Ka·Kh=Kw,⑤正确;
,所以三者关系为Ka·Kh=Kw,⑤正确;
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,若两种溶液的pH之和等于14,则等体积混合液pH等于7,⑥正确;
综上所述可知,正确的说法为③⑤⑥,故合理选项是D。

 阅读快车系列答案
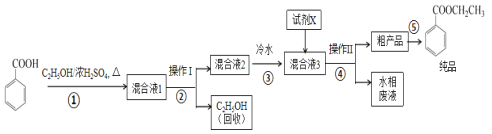
阅读快车系列答案【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如图:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为__。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2h。仪器A的作用是__。
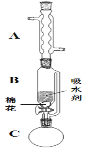
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为__。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_;操作II所用的玻璃仪器除了烧杯外还有__。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有__;加入试剂X为___(填写化学式)。
(6)最终得到产物纯品10.0g,实验产率为__%(保留三位有效数字)。
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
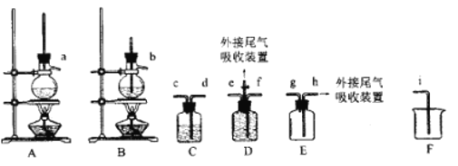
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。