题目内容
【题目】反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0
FeO(s)+CO(g)△H>0
反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)△H<0
FeO(s)+H2(g)△H<0
若反应①在温度T1下进行,反应②在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)
(其他条件均相同),下面对两者反应速率大小判断正确的是( )
A. 反应①快 B. 反应②快 C. 一样大 D. 无法判断
【答案】D
【解析】影响化学反应速率的主要因素是物质的性质,物质越活泼,反应速率越大,而浓度、温度为影响化学反应速率的外因,比较温度、浓度对化学反应速率的影响只能针对于同一个化学反应,如Na和HCl溶液剧烈反应;但无论温度多高、浓度多大,Cu都不与盐酸反应,所以无法比较两个反应的速率大小,故选D。

【题目】能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变 d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=_________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=_________。
(2)已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
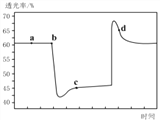
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc

