题目内容
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
B
解析试题分析:①F2、Cl2、Br2、I2都是分子晶体,通过分子间作用力结合。分子间作用力越大,晶体的熔点、沸点就越高。对于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。相对分子质量:F2<Cl2<Br2<I2。所以熔沸点:F2<Cl2<Br2<I2。这与化学键无关。错误。②HF、HCl、HBr、HI的热稳定性的强弱与这几种元素的非金属性大小有关。元素的非金属性越强,其氢化物中含有的共价键就越强,断裂它消耗的能量就越高,氢化物就越稳定。非金属性:F>Cl>Br>I,所以稳定性:HF>HCl>HBr>HI。正确。③金刚石、碳化硅、晶体硅都是由原子通过共价键结合的原子晶体。共价键越强,破坏它使物质融化或汽化需要消耗的能量就越高,物质的熔沸点就越高。而共价键的强弱与形成共价键的原子半径的大小有关。原子半径越小,共价键就越强。原子半径:Si>C,所以键长:Si-Si>Si-C>C-C,故熔点逐渐降低。正确。④NaF、NaCl、NaBr、NaI都是通过离子键结合而成的晶体。离子键越强,熔沸点就越高。而离子键的强弱与离子所带电荷的多少盒离子半径有关。离子所带的电荷越多,离子半径越小,离子键就越强。其熔沸点就越高。离子键:NaF>NaCl>NaBr>NaI,所以熔沸点:NaF>NaCl>NaBr>NaI。与共价键无关。错误。与共价键的键能大小无关的是①④。选项为:B.
考点:考查物质性质的变化规律与化学键的关系的知识。

工业上采用NH3作还原剂脱氮原理为:
NO(g)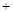 NO2(g)
NO2(g)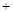 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)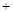 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是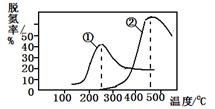
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
能够表示燃烧热的是( )
| A.2H2(g)+O2(g)=2H2O(g);△H1 |
| B.S(g)+O2(g)= SO2 (g);△H1 |
C.C(s)+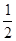 O2(g)= CO(g);△H1 O2(g)= CO(g);△H1 |
| D.H2(g)+Cl2(g) = 2HCl(g);△H1 |
下列依据热化学方程式得出的结论正确的是
| A.若2H2(g)+O2(g) =2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.若C(石墨,s) =C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g) =2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2 |
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 ②
H2O(g)=H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+0.5Q2+9Q3 | D.4Q1+2Q2 |
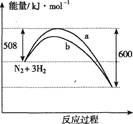
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
| A.该反应的热化学方程式为: N2+3H2  2NH3ΔH =-92 kJ·mol-1 2NH3ΔH =-92 kJ·mol-1 |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.图中曲线b表示使用了催化剂 |
已知在1×105Pa,298K条件下,2mol氢气完全燃烧生成水蒸气放热484kJ,下列热化学方程式正确的是( )
| A.2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l);ΔH =-484kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g);ΔH =+242kJ·mol-1 O2(g)=H2O(g);ΔH =+242kJ·mol-1 |
D.H2O(g)=H2(g)+ O2(g);ΔH =+242kJ·mol-1 O2(g);ΔH =+242kJ·mol-1 |