题目内容
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的标准燃烧热________(填“大于”“等于”“小于”或“不能确定”)-676.7 kJ·mol-1。已知水的气化热为44 kJ·mol-1,则氢气燃烧的热化学方程式为__________________________。
(1)TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(2)不能确定 H2(g)+ O2(g)=H2O(l) ΔH=-285.9 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.9 kJ·mol-1
解析试题分析:(1)将①+②可得:TiO2(s)+2C(s)+2Cl2(g)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(2)由于A产物是氢气,不是化合物,B产物是气态的水,不是稳定的化合物的状态。所以不能确定CH3OH的标准燃烧热。将(A─B)÷3可得:H2(g)+1/2O2(g)=H2O(g) ΔH= -241.9KJ/mol.由于水的气化热为44 kJ·mol-1,所以氢气燃烧的热化学方程式为:H2(g)+ O2(g)=H2O(l) ΔH=-285.9 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.9 kJ·mol-1
考点:考查盖斯定律及应用。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案将1000 mL 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1000 mL 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为
| A.(5a-2b) kJ | B.(2b-5a) kJ |
| C.(5a+2b) kJ | D.(10a+4b) kJ |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0 |
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
下列关于燃烧热的描述中正确的是( )
| A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1 |
B.将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+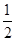 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800kJ·mol-1,则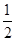 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+ O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
Hg(l) + O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ? mol-1 ③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
下列有关能量转换的说法正确的是( )
| A.煤燃烧是化学能全部转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 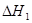 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g)  = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)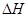 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |