题目内容
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 ②
H2O(g)=H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+0.5Q2+9Q3 | D.4Q1+2Q2 |
C
解析试题分析:气体总物质的量为:112L÷22.4L/mol=5mol,则甲烷为4mol,完全燃烧生成H2O(g)时放热为4Q1;氢气为1mol,完全燃烧生成H2O(g)时放热为0.5Q2;共生成9mol H2O(g),转化为H2O(l)放热9Q3;所以共放热:4Q1+0.5Q2+9Q3,故C项正确。
考点:本题考查反应热的计算。

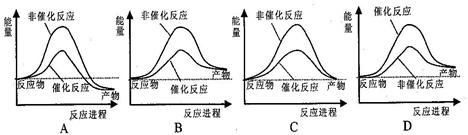
以下关于下图说法正确的是
| A.如图表明催化剂可以改变反应的热效应 |
| B.如图表示某反应能量的变化与生成物状态无关 |
| C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0 |
已知H-H、Cl-Cl和H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成2mol H-Cl 时的热效应△H等于( )
| A.-183 kJ·mol-1 | B.-91.5kJ·mol-1 |
| C.+183kJ·mol-1 | D.+ 91.5kJ·mol-1 |
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+ O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
Hg(l) + O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ? mol-1 ③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
已知:
(1)Fe2O3(s) +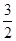 C(s)=
C(s)=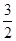 CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+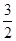 O2(g)=Fe2O3(s) 的ΔH是( )
O2(g)=Fe2O3(s) 的ΔH是( )
| A.-824.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |