��Ŀ����
��ҵ�ϲ���NH3����ԭ���ѵ�ԭ��Ϊ��
NO(g)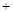 NO2(g)
NO2(g)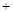 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)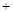 3H2O(g)��
3H2O(g)��
������һ��������ͨ����������ͬ�¶����ݳ������е������ﺬ�����Ӷ�ȷ������Ч�ʣ���ͼ�����ֲ�ͬ�������ѵ�Ч�����ߣ��ж����·�����ȷ����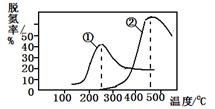
| A��������Ӧ������ӦΪ���ȷ�Ӧ |
| B�������١��ڷֱ��ʺ���250���450 �������ѵ� |
| C�����ߢ١�����ߵ��ʾ��ʱƽ��ת������� |
| D����ͬ�����£��ı�ѹǿ���ѵ���û��Ӱ�� |
B
����������������ڷ�ӦΪ��NO(g) + NO2(g) + 2NH3(g) 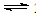 2N2(g) + 3H2O(g)����ͼ���֪����ͬ�����£���ʼʱ���¶ȵ������ѵ������������¶ȵ������ѵ�����С����ߵ��ʾ�ﵽƽ��״̬��ƽ����������¶��ѵ��ʷ����Ǽ�С�ģ����ԣ��÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��A�����÷�ӦΪ�ǵ������Ӧ��ѹǿ�ĸı�����Ӱ���ѵ��ʣ�����D�������ߢ١�����ߵ��ʾ��Ӧ�ﵽƽ��״̬��C������ͼ�η�����֪�����١��ڷֱ��ʺ���250���450�������ѵ���B��ȷ��
2N2(g) + 3H2O(g)����ͼ���֪����ͬ�����£���ʼʱ���¶ȵ������ѵ������������¶ȵ������ѵ�����С����ߵ��ʾ�ﵽƽ��״̬��ƽ����������¶��ѵ��ʷ����Ǽ�С�ģ����ԣ��÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��A�����÷�ӦΪ�ǵ������Ӧ��ѹǿ�ĸı�����Ӱ���ѵ��ʣ�����D�������ߢ١�����ߵ��ʾ��Ӧ�ﵽƽ��״̬��C������ͼ�η�����֪�����١��ڷֱ��ʺ���250���450�������ѵ���B��ȷ��
���㣺������Ҫ�������ͼ�����ת���ʼ���Ӧ�ȣ�ƽ���ƶ������

 ��У����ϵ�д�
��У����ϵ�д����з�Ӧ������������������ڷ�Ӧ���������ķ�������ԭ��Ӧ��
| A�����ȷ�Ӧ | B���Ȼ�����Һ��ˮ�� |
| C���������ƺ����ᷴӦ | D����̿�ڸ�������ˮ������Ӧ |
��(N2H4)��һ�ֿ����ڻ����ԭ��ص�ȼ�ϡ���֪��
N2(g) + 2O2(g) ��2 NO2(g) ��H =" +67.7kJ/mol" ����������������������
N2H4(g) + O2(g) �� N2(g) + 2H2O(g)����H = ��534 kJ/mol ��
����˵����ȷ����
| A����Ӧ���з�Ӧ�������е����������������������е������� |
| B��2N2H4(g) + 2NO2(g) �� 3N2(g)+ 4H2O (g) ��H = ��1000.3kJ/mol�� |
| C�������缫��KOH��Һ���������Һ���ɷ�Ӧ����Ƶ�ȼ�ϵ���为����Ӧʽ��N2H4��4e��+4OH����N2+4H2O |
| D�������缫��KOH��Һ���������Һ���ɷ�Ӧ����Ƶ�ȼ�ϣ�����һ��ʱ���KOH��Һ��pH������ |
���¹�����ͼ˵����ȷ����
| A����ͼ�����������Ըı䷴Ӧ����ЧӦ |
| B����ͼ��ʾij��Ӧ�����ı仯��������״̬�� |
| C����ͼ��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯 |
| D����ͼ������ѧ��Ӧ������ѭ�����غ㶨�ɣ�Ҳ��ѭ�����غ� |
����ͼ��ʾ����H1=��393.5 kJ?mol-1����H2=��395.4 kJ?mol-1������˵�����ʾʽ��ȷ����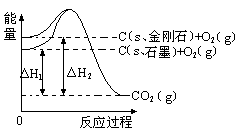
| A��ʯī�ͽ��ʯ��ת���������仯 |
| B��1molʯī����������1 mol���ʯ����������1.9 kJ |
| C�����ʯ���ȶ���ǿ��ʯī |
| D��C(s��ʯī)=C(s�����ʯ) ��H=" +1.9" kJ?mol-1 |
��1000 mL 0��1 mol��L��1 BaCl2��Һ������ϡ�����ַ�Ӧ�ų�a kJ��������1000 mL 0��5 mol��L��1 HCl��Һ������CH3COONa��Һ��ַ�Ӧ�ų�b kJ����(�����Ǵ�����ˮ��)����500 mL 1 mol��L��1 H2SO4��Һ������(CH3COO)2Ba(������ǿ�����)��Һ��Ӧ�ų�������Ϊ
| A��(5a��2b) kJ | B��(2b��5a) kJ |
| C��(5a��2b) kJ | D��(10a��4b) kJ |
��ͬ��ͬѹ��,���и����Ȼ�ѧ����ʽ�У���H2>��H1����
| A��S(g)+O2(g)��SO2(g)����H1�� S(s)+O2(g)��SO2(g)����H2 |
| B��2H2(g)+O2(g)��2H2O(g)����H1�� 2H2(g)+O2(g)��2H2O(l)����H2 |
C��C(s)+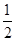 O2(g)=CO(g)��H1��C(s)+O2(g)=CO2(g)��H2 O2(g)=CO(g)��H1��C(s)+O2(g)=CO2(g)��H2 |
| D��H2(g)+Cl2(g)��2HCl(g)����H1�� 2H2(g)+2Cl2(g)��4HCl(g)����H2 |
�����������ʵı仯���ɣ��빲�ۼ��ļ��ܴ�С�ص��ǣ� ��
��F2��Cl2��Br2��I2���۵㡢�е������� ��HF��HCl��HBr��HI�����ȶ������μ���
�۽��ʯ��̼���衢������۵����� ��NaF��NaCl��NaBr��NaI���۵����ν���
| A������ | B���٢� | C���ڢ� | D���٢ڢ� |
��֪����1 mol H2�����л�ѧ������ʱ��Ҫ����436 kJ����������1 mol Cl2�����л�ѧ������ʱ��Ҫ����243 kJ������������Hԭ�Ӻ�Clԭ���γ�1 mol HCl����ʱ�ͷ�431 kJ������������������ȷ���� (����)��
| A��������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��H2(g)��Cl2(g)===2HCl(g) |
| B��������������Ӧ����2 mol�Ȼ������壬��Ӧ�Ħ�H����183 kJ��mol��1 |
| C��������������Ӧ����2 mol�Ȼ������壬��Ӧ�Ħ�H����183 kJ��mol��1 |
| D��������������Ӧ����1 mol�Ȼ������壬��Ӧ�Ħ�H����183 kJ��mol��1 |