题目内容
下列依据热化学方程式得出的结论正确的是
| A.若2H2(g)+O2(g) =2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.若C(石墨,s) =C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g) =2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2 |
B
解析试题分析:A、燃烧热是指在一定压强下,1 mol的可燃物完全燃烧生成稳定的氧化物的时候所放出的热量。而这个反应中的水是气态,错误; B、石墨转化为金刚石为啊吸热反应表明金刚石能量高,能量高的一般不稳定,正确;C、氢氧化钠溶于水要放热,错误;D、比较ΔH1和ΔH2的相对大小,是要带上正负号来比较的,错误。
考点:考查反应热的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
肼(N2H4)是一种可用于火箭或原电池的燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH =" +67.7kJ/mol" ①
N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -534 kJ/mol ②
下列说法正确的是
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2H4(g) + 2NO2(g) = 3N2(g)+ 4H2O (g) ΔH = -1000.3kJ/mol |
| C.铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料电池其负极反应式:N2H4-4e-+4OH-=N2+4H2O |
| D.铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料,工作一段时间后,KOH溶液的pH将增大 |
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
| A.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 |
| B.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 |
C.C(s)+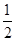 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g)△H2 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g)△H2 |
| D.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
关于中和热测定实验的下列说法不正确的是
| A.烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 |
| B.使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C.向盛装酸的烧杯中加碱时要小心缓慢 |
| D.测了酸后的温度计要用水清洗后再测碱的温度 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O △H﹤0 |
下列依据热化学方程式得出的结论正确的是
| A.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
下列物质性质的变化规律,与共价键的键能大小无关的是( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
下列关于燃烧热的描述中正确的是( )
| A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1 |
B.将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+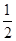 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800kJ·mol-1,则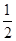 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 |
下列原理所测的中和热最接近-57.3 kJ/mol的是( )
| A.将标况下11.2L HCl气体通入50mL 0.01 mol/L NaOH溶液中反应 |
| B.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L HNO3溶液反应 |
| C.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L H2SO4溶液反应 |
| D.用55mL 0.01 mol/L NaOH溶液与50mL 0.01 mol/L HF溶液反应 |