题目内容
16.下列关于氯元素的说法正确的是( )| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
分析 A.非金属强弱的判断依据是最高价含氧酸的酸性越强,对应非金属性越强;
B.同位素化学性质相同;
C.温度和压强不同,气体摩尔体积不同,无法计算氯气的物质的量;
D.氧化还原反应在氧化剂的氧化性大于氧化产物,非金属单质氧化性越强,非金属性越强.
解答 解:A.非金属强弱的判断依据是最高价含氧酸的酸性越强,对应非金属性越强,HCl具有很强的酸性,氮不是最高价含氧酸,不能说明非金属性强弱,故A错误;
B.这两种原子属于同位素,同位素的核外电子数及电子排布相同,所以同位素化学性质相同但物理性质不同,故B错误;
C.温度和压强未知,所以气体摩尔体积未知,导致无法计算气体的物质的量,所以无法计算含有质子数,故C错误;
D.氯气和KI溶液反应置换出I2,氯气的氧化性大于碘单质,说明氯的非金属性比碘强,故D正确;
故选D.
点评 本题考查了氯气的性质、氧化还原反应强弱规律、非金属性判断依据和方法,气体摩尔体积的应用条件分析等知识点,易错选项是C,有关气体体积的计算要注意温度和压强,为易错点,题目难度中等.

练习册系列答案
相关题目
6.如图所示图象,不能正确反映其对应变化关系的是( )
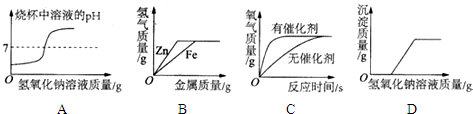

| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
11.a b c d四个集气瓶中装有Cl2 H2 HCl HBr的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现红棕色液滴,则a b c d瓶气体是( )
| A. | Cl2 HBr HCl H2 | B. | Cl2 HCl HBr H2 | C. | H2HBr HCl Cl2 | D. | H2 HCl HBr Cl2 |
8.下列分子式中只表示一种纯净物的是( )
| A. | C2H4Cl2 | B. | C2H3Cl3 | C. | C2HCl3 | D. | C2H2Cl2 |
7.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能.非常适合进行现场酒精检测.下列说法不正确的是( )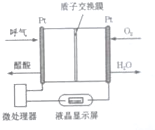

| A. | 电流由O2所在的铂电极流出 | |
| B. | O2所在的铂电极处发生还原反应 | |
| C. | 该电池的负极反应式为CH3CH2OH+3H2O-12e-=2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量. |
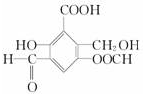 取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.
取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.