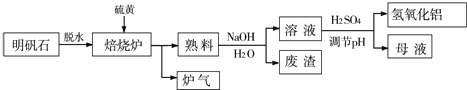
题目内容
15.下列说法中正确的是( )| A. | NaHSO4熔化时,离子键和共价键均被破坏 | |
| B. | 过氧化氢中只有非极性共价键 | |
| C. | 金属元素与非金属元素化合时,一定形成离子键 | |
| D. | 非金属元素也可能形成离子键 |
分析 A.硫酸氢钠固体熔化时电离出钠离子和硫酸氢根离子;
B.过氧化氢中存在H-O极性键;
C.金属元素与非金属元素间可以形成共价键;
D.铵根离子与酸根离子之间形成离子键.
解答 解:A.硫酸氢钠固体熔化时电离出钠离子和硫酸氢根离子,所以只破坏离子键不破坏共价键,故A错误;
B.过氧化氢中存在H-O极性键和O-O非极性键,故B错误;
C.金属元素与非金属元素间可以形成共价键,如氯化铝中存在由金属元素与非金属元素形成的共价键,故C错误;
D.铵根离子与酸根离子之间形成离子键,所以非金属元素也可能形成离子键,故D正确.
故选D.
点评 本题考查了化学键,注意把握离子键和共价键的区别,题目难度不大,注意非金属元素也可能形成离子键如铵盐.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
6.如图所示图象,不能正确反映其对应变化关系的是( )
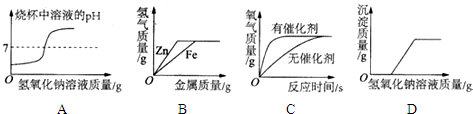

| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
3.在某个容积为2L的密闭容器内,在T℃时按下图所示发生反应2A(g)+B(g)?3D(g)+E(s)△H<0.下列措施能增大B的转化率的是( )


| A. | 再投入2molA和1molB | B. | 保持体积不变通入1molB | ||
| C. | 移出部分物质B | D. | 再投入2molA,1molB和0.6molD |
10.一定温度下,反应 N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容,充入He | D. | 恒压,充入He |
20. 如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )
 如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表指针发生偏转,且a极上有大量气泡生成,则下列叙述正确的是( )| A. | a为负极,是铁片,烧杯中的溶液为稀硫酸溶液 | |
| B. | b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 | |
| C. | a为正极,是碳棒,烧杯中的溶液为稀硫酸溶液 | |
| D. | b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
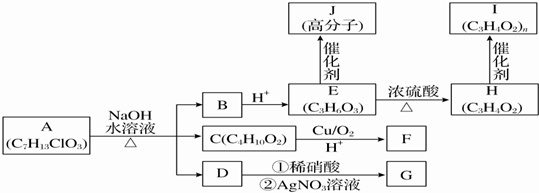
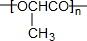 .
.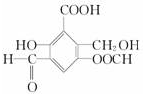 取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.
取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.