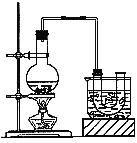
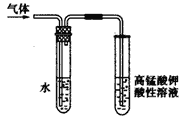
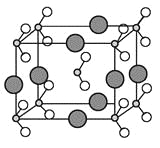
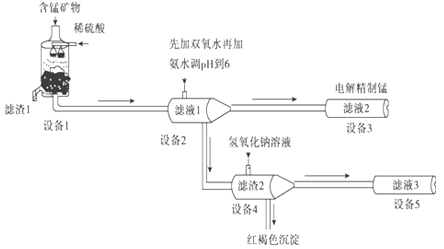
题目内容
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )
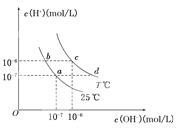
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl―、SO42―
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH―、I―
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl―、HCO3―
D.d点对应的溶液中大量存在:Na+、K+、SO32―、Cl―
【答案】D
【解析】
试题分析:A.Fe3+水解显酸性,而a点对应的溶液显中性,则离子不能大量共存,故A错误;B.NH4+与OH-反应生成一水合氨,故二者不能大量共存,故B错误;C.HCO3-水解显碱性,而c点对应的溶液显中性,则离子不能大量共存,故C错误;D.d点时c(H+)<c(OH-),溶液碱性,Na+、K+、SO32-、Cl-不反应,能大量共存,故D正确;故选D。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | |||
3 | ⑦ | ⑧ | ⑨ | |||||
4 | ⑩ |
(1)在这些元素中,化学性质最不活泼的是 ,元素原子半径最小的是 ,被称为“国防金属”的是 ,可作为半导体材料的是 ,单质氧化性最强的元素是 。
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是 。
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是 。酸性最强的化合物的化学式是 。
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式 。
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________。