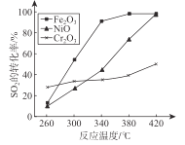
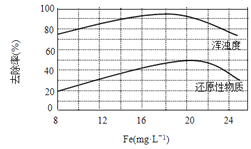
题目内容
【题目】下列关于粒子结构的描述不正确的是( )。
A. H2S和NH3均是价电子总数为8的分子
B. HS-和HCl均是含一个极性键的18电子粒子
C. CO2的电子式为![]()
D. 1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
【答案】C
【解析】试题分析:A.H2S和NH3均是价电子总数为8的分子,A正确;B.HS-和HCl均是含一个极性键的18电子粒子,B正确;C.CO2的电子式为![]() ,C错误;D.1个D216O分子中含质子数:2+8=10,含中子数:2+8=10,含电子数等于质子数,也为10,因此1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值),D正确。故答案C。
,C错误;D.1个D216O分子中含质子数:2+8=10,含中子数:2+8=10,含电子数等于质子数,也为10,因此1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值),D正确。故答案C。

练习册系列答案
相关题目
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | |||
3 | ⑦ | ⑧ | ⑨ | |||||
4 | ⑩ |
(1)在这些元素中,化学性质最不活泼的是 ,元素原子半径最小的是 ,被称为“国防金属”的是 ,可作为半导体材料的是 ,单质氧化性最强的元素是 。
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是 。
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是 。酸性最强的化合物的化学式是 。
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式 。
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________。